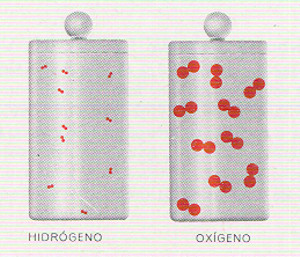
Pero ¿qué es, exactamente, la energía? No es algo que pueda siempre ser observado por los sentidos. Si un físico quisiera describir una manzana a alguien que hubiese visto una, le bastaría con poner uno de esos frutos sobre una mesa, y dejarle que lo palpase, lo oliese y lo probase. Pero no es posible poner la energía sobre la mesa, puesto que, según el texto y los grabados de este libro demuestran claramente, la energía puede aparecer en diversas formas. Puede presentarse como energía de movimiento o cinética; en forma de calor y de luz; a escala atómica o molecular, como energía química; en el flujo de la corriente eléctrica y, a escala nuclear, en una de sus formas más espantosas, como energía nuclear. Puede, incluso, aparecer en forma de manzana, como le ocurrió (así lo cuentan) a sir Isaac Newton, a quien la caída de una manzana condujo al descubrimiento de la gravitación. Al caer, la manzana liberé energía potencial.
Si bien el dominio de la energía explica el desarrollo de la civilización, puede también conducir a la ruina de la humanidad. Al disponer cada vez de más energía, no solamente podemos mejorar nuestra vida cotidiana, sino también, por desgracia, podemos hacer la guerra con más eficiencia y a mayor escala. La energía nuclear, que tanto promete para un futuro pacífico, podría muy bien ser la causa de la destrucción del mundo. Si nosotros y nuestros hijos, y los hijos de nuestros hijos, hemos de evitar esta catástrofe, es imperativo que nos comprendamos a nosotros mismos y a lo que nos rodea. No hay mejor manera de empezar que investigando la naturaleza de la energía.
Glenn T. Seaborg,
Presidente de la Comisión de Energía Atómica
Capítulo 1
Móvil primordial del universo
ALEGRÍA DE LA ENERGÍA. Los exaltados niños al precipitarse batiendo brazos y piernas en las aguas del Estrecho de Long Island, Nueva York, constituyen la encarnación de una ruidoso energía. La energía está siempre presente a nuestro alrededor en innumerables formas, pero en ninguno parte parece abundar de modo tan evidente como en la animación del niño.
En el lenguaje con que designamos al mundo que nos rodea, damos por supuesto el significado de la palabra «energía»; en la vida diaria sugiere movimiento, vitalidad, fuerza. «Un hombre enérgico» es un hombre a quien admirar; nos dicen que los alimentos «de elevado contenido de energía» deben formar parte de nuestro régimen alimenticio; las compañías petrolíferas llenan la campiña de carteleras que anuncian «combustible de elevada energía». Es una palabra que ha dado al mundo moderno una nueva actitud hacia la vida. Pero ¿qué significa, en realidad, «energía»? En su sentido popular, ofrece una promesa de logro; un hombre enérgico es aquel que vive con entusiasmo, y la gasolina de gran energía es la que hace que nuestro automóvil corra más y mejor.
A decir verdad, el hombre moderno no tiene dificultad en representarse a la energía y la materia como los dos aspectos del universo. Materia y energía unidas forman nuestro cosmos, la materia, la sustancia; la energía, el móvil de la sustancia. Pero ese dualismo no es una idea sencilla, y el concepto mismo de energía es relativamente reciente en el mundo del saber. Invisible e impalpable, la energía solamente puede ser imaginada en la mente del hombre. La manera en que llegó a ser concebida en toda su complejidad, y cómo llegó a ser utilizada en nuestras vidas diarias, constituye una de las mejores historias detectivescas de la historia de la ciencia.
La materia ha sido siempre un concepto mucho más asequible para el hombre. La materia es sustancia; pesa y ocupa lugar; puede ser vista, olida, palpada. Una cosa es ver venir una piedra lanzada con furia y sentir la herida que produce su impacto, y otra cosa mucho más difícil es imaginar que en aquella piedra en movimiento existe una cualidad intangible que parece desvanecerse tan pronto como vuelve a alcanzar el suelo. Y, no obstante, fue reflexionando sobre objetos en movimiento que el hombre comenzó a desarrollar su concepto de energía; en último término consideraría a la energía como el poder que todo lo abarca en el universo.
Los antiguos griegos, que se interrogaban sobre todas las cosas, estaban seguros de que los cuerpos pesados se caían al suelo impulsados por cierto deseo interno de «buscar sus lugares propios», pero esa idea no les condujo nunca a ningún examen científico importante de los cuerpos en caída. Aristóteles postuló un «Móvil inmóvil» que se esforzaba perpetuamente por mantener los planetas en movimiento, y durante siglos después de su tiempo se supuso siempre que todo movimiento requería una fuerza continua para mantenerlo. Las flechas y las balas de los cañones, una vez disparadas, se mantenían en movimiento horizontal gracias a la ayuda del aire que las empujaba por detrás dirigiéndolas hacia su fin destructor, pues Aristóteles creía que un objeto volador comprimía el aire a través del cual se movía, haciendo que ese aire se precipitase hacia la parte posterior del objeto, proporcionándole una fuerza suplementaria.
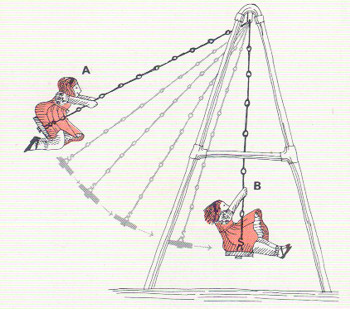
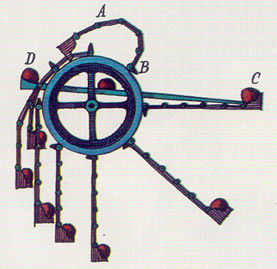
ENERGÍA EN EL CAMPO DE JUEGO. Una niña en un columpio sirve de ejemplo de la diferencia entre energía potencial y energía cinética. En A, punto de inmovilidad momentánea, justo antes de precipitarse hacia abajo, la niña posee solamente energía potencial, y a medida que va descendiendo desarrolla energía cinética. A mitad del ciclo, en B, su energía es exclusivamente cinética; luego, progresivamente, vuelve o convertirse en potencial a medida que el columpio vuelve a elevarse. Debido a la fricción, el ciclo no continúa indefinidamente; para que continúe la diversión hay que seguir empujando.
Esas ideas iban a ser destruidas por aquel tenaz enemigo de las ideas aristotélicas erróneas, Galileo Galilei. El verdadero estudio de la energía, y en realidad el de toda la ciencia física moderna, comenzó en la fértil mente de ese genio italiano del siglo XVI. Galileo, dice la leyenda, efectuó su primera observación conocida de los fenómenos físicos en 1583, a la edad de 19 años, cuando fue distraído de sus oraciones en la catedral de Pisa por la oscilación rítmica de una lámpara suspendida de una larga cadena. Observó que, mientras que el movimiento del arco, hacia adelante y hacia atrás, se iba haciendo cada vez más pequeño, el tiempo que la lámpara tardaba en desplazarse de un lado a otro permanecía constante. Como el reloj de bolsillo no había sido aún inventado, Galileo, sencillamente, contaba el número de sus propias pulsaciones a cada oscilación.
Utilizando luego cordeles y varios pesos sencillos, Galileo construyó diversos péndulos primitivos y estudió cuidadosamente su comportamiento. Observó que cada vez que un péndulo oscila hacia arriba llega hasta casi tan alto como el punto desde el cual había previamente oscilado hacia abajo. Así Galileo pudo afirmar confiadamente que «en general, el momento adquirido por caída a lo largo de un arco (de péndulo) es igual al que puede elevar el mismo cuerpo a lo largo del mismo arco».
Continuando con las caídas
Encantado con los que los cuerpos en caída le prometían, Galileo atacó otra teoría generalmente aceptada por los aristotélicos, quienes habían afirmado arbitrariamente que los cuerpos caían a velocidades que dependían de su peso.
La investigación empezó a tomar forma entre los matemáticos. En el siglo XVII, hombres como René Descartes, Isaac Newton y Gottfried Wilhelm von Leibniz, procuraron clasificar la idea de la fuerza que hoy comúnmente llamamos empujar o tirar. Habiendo observado que la fuerza obraba sobre los objetos poniéndolos en movimiento, intentaron al principio definir la fuerza en términos de la cantidad de movimiento que producía. Se enfrentaron con preguntas tales como las siguientes: ¿Cómo podría medirse el efecto de una fuerza? ¿Cómo podrían compararse los efectos de dos fuerzas diferentes?
Leibniz, al intentar idear alguna manera de medir las fuerzas, estudió los experimentos de Galileo con los cuerpos en caída, quien había observado que todos los cuerpos caen a la misma velocidad, cualquiera que sea su tamaño o su peso. No obstante, Leibniz se dio cuenta de que un objeto que pesase una tonelada haría mucho más daño al alcanzar el suelo que uno que pesase una onza, aun cuando los dos llegasen al mismo tiempo. Ahí había una manera de medir la fuerza; se trataba sencillamente de idear una manera de medir la magnitud del impacto que el objeto producía. Es perfectamente evidente, decía Leibniz, que el impacto depende de dos cosas: de cuánto pesa el objeto y desde qué altura cae. Se trata de una observación de sentido común, pues todo el mundo sabe que un ladrillo que cae de un metro causa menos daño que uno que cae de cien metros.
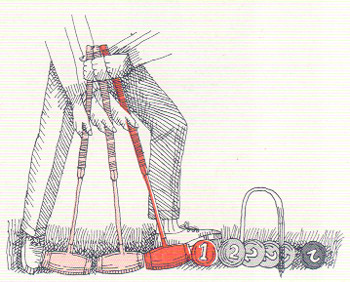
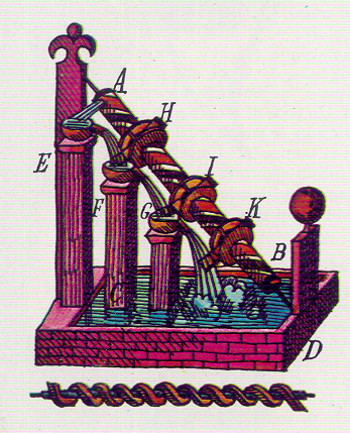
EN TODOS LOS JUEGOS SE CONSERVA LA ENERGÍA. La energía puede variar de forma, pero no puede ser creada ni destruida; ésta es la ley fundamental de la conservación de la energía. Por ejemplo, el jugador de croquet, con el pie, pone en posición la bola 1, contra la bola de su adversario, 2. Luego golpea con su mazo y transmite energía o través de la bola 1 a la bola 2, la cual sale disparada.
Pero supongamos que no nos interesa la fuerza creada por un objeto que cae, sino que lo que nos interesa es un objeto que se eleva por el aire, como una pelota que se lanza a lo alto, o que rueda horizontalmente, como una bocha. ¿Dónde entra la altura en tales medidas? Leibniz se dio cuenta de que no era la altura lo realmente importante, sino la velocidad a que caía el objeto, la cual, naturalmente, resulta también estar directamente relacionada con la altura desde la cual cae. Cuanto mayor es la caída, tanto mayor es la velocidad. Leibniz modificó su fórmula diciendo que la medida de la fuerza dependía del peso del objeto y de la velocidad a que iba.
Leibniz luego inventó un nombre para el impacto, y lo llamó vis viva, que quiere decir fuerza viva; era la cualidad que poseía el objeto que le permitía dañar a otro objeto. La fórmula que Leibniz utilizó para medir la vis viva es la misma que los físicos modernos utilizan para medir la «energía cinética», la energía del movimiento. Lo que Leibniz había hecho era elaborar una descripción matemática de la energía cinética.
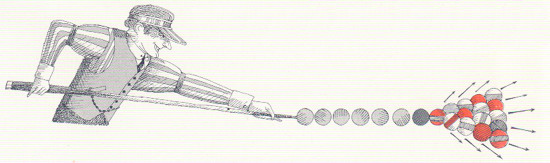
UN PAR DE DEPORTES ENÉRGICOS. El taco de billar ejerce el mismo efecto sobre la bola que impulsa la ringlera de bolas. En ambos casos, podría demostrarse que la energía total de las bolas de croquet o de billar en movimiento es igual o la suministrada por el mazo o el taco, teniendo en cuenta las pérdidas por fricción.
Al mismo tiempo que Leibniz, en Alemania, estudiaba los cuerpos en movimiento, el matemático holandés Christian Huygens realizaba una investigación relacionada con aquel estudio. Huygens empleó largas horas estudiando lo que ocurría cuando chocaban dos objetos en movimiento, y en 1699 se publicaron los resultados de sus meticulosas observaciones, los cuales declaraban que en una colisión tal como la que podría producirse entre dos bolas de billar perfectamente duras, la suma de la vis viva en cada una de las dos bolas es la misma antes y después del impacto. Una bola puede haber sido retardada por la colisión, pero la otra habrá sido acelerada. Por lo tanto, la suma de las dos vis vivas será siempre la misma.
Una vieja ley enmendada
Hoy en día podemos darnos cuenta de que, al reemplazar la expresión vis viva por la de «energía cinética», la observación de Huygens significa que, cuando dos objetos chocan, la energía cinética se conserva: es decir, que si bien puede ser modificada, no se pierde nada de ella. En esa observación de Huygens, del siglo XVII, se halla el principio de un concepto fundamental de la física moderna: la Ley de la Conservación de la Energía, formulada al fin de la década de 1840, la cual sencillamente afirma que la energía del universo no puede ser ni creada ni destruida. En el curso de los últimos 100 años la aplicación original de esta ley al estudio de la energía cinética ha sido ampliada hasta cubrir todas las demás formas en que la energía se manifiesta. Solamente en años recientes, al descubrirse que la materia podía ser transformada en energía, y la energía a su vez en materia, ha sido preciso enmendar la Ley. Pero para las formas de la energía ordinaria sigue siendo tan precisa y aplicable hoy como era en 1699.
Hacia principios del siglo XIX, y cuando hacía más de 100 años que el concepto de vis viva había sido aceptado, un estratega militar francés llamado L. N. M. Carnot concibió una sutil idea. (Un hijo suyo, Sadi, aportó posteriormente una idea igualmente vital al estudio de la energía calorífica.) Carnot se dio cuenta de que un peso situado en una posición elevada posee energía por el solo hecho de estar en una situación tal que pueda caer y crear, por lo tanto, energía cinética. Carnot llamó a esa capacidad vis viva «latente», precursora exacta de otra noción moderna, la «energía potencial», la más conocida compañera de la energía cinética.
Carnot identificó la vis viva latente en 1803. Cuatro años más tarde, en 1807, la palabra «energía» entró por vez primera en el vocabulario técnico de la ciencia. La palabra «energía», que en griego originalmente significaba «trabajo», fue propuesta para designar muchos de los fenómenos que inicialmente se atribuyeron a la vis viva. Esa propuesta fue hecha por un notable médico y físico inglés, Thomas Young, quien a los 19 años había comenzado el estudio de la medicina, y a los 28 había sido nombrado profesor de Filosofía Natural de la Royal Institution de Londres. Young ha sido descrito como «uno de los hombres de más clara visión que haya jamás existido», y su admirador añadía que la desgracia de Young había sido «ser de sagacidad inmensamente superior a la de sus contemporáneos». Una de sus ideas, que permaneció ignorada durante décadas, fue su aguda definición de la energía como capacidad para efectuar un trabajo, la cual se encuentra en el centro de cualquier comprensión de la energía.
Trabajo de definición
En general, y según se entiende generalmente ahora, «trabajo» significa la aplicación de un esfuerzo para realizar una tarea; en los términos más amplios, cualquier esfuerzo físico puede ser descrito como trabajo. Cuando el hombre fuerte del circo se alza en el centro del haz de proyectores, y al redoblar de los tambores levanta una pesa de doscientos kilos, no hace sino realizar un trabajo. Incluso algo en apariencia tan insignificante como la atracción de un alfiler común por un pequeño imán es también evidencia de esfuerzo físico, el imán también realiza un trabajo.
En su sentido exacto, trabajo supone la aplicación de alguna fuerza, y el concepto científico incluye la idea en la forma más específica posible: se define el trabajo como «la aplicación de una fuerza a través de una distancia». Es la fuerza de cierto número de kilos, gramos o toneladas que levanta, empuja o tira de un objeto a través de un número dado de metros o kilómetros. En cierto modo, trabajo es energía hecha tangible, que puede ser aplicada de innumerables formas, puesto que el trabajo cubre actividades tan dispares como la construcción de las antiguas pirámides, la creación de los núcleos atómicos y la formación de las estrellas. La velocidad a que se efectúa el trabajo recibe el nombre de «potencia»; por ello todas las máquinas se describen en términos de «potencial útil», siendo la relación entre potencia y trabajo semejante a la relación entre velocidad y distancia.
La energía, en forma de trabajo, se manifiesta en numerosas formas, no todas las cuales son igualmente evidentes para el profano; sus numerosos nombres actuales distan mucho de aquella idea relativamente sencilla de energía mecánica, según fue definida por vez primera por Thomas Young hace más de 150 años. Ahora se habla, por lo menos, de otras cinco formas principales de energía: energía calorífica y luminosa, además de la química, eléctrica y nuclear. Todas ellas están estrechamente conectadas entre sí y se encuentran en el ejemplo familiar del tren de vapor.
La energía mecánica, en forma de pistones móviles, impulsa las ruedas de la locomotora, y parte de ese movimiento acciona generadores situados bajo los vagones, los cuales crean energía eléctrica, que proporciona calor y luz a los pasajeros. La energía eléctrica sobrante se utiliza para cargar baterías donde se convierte en energía química. Cuando se detiene el tren, las baterías invierten el proceso y se encargan de mantener la luz y el calor. El calor del vapor es el que suministra la energía mecánica a la locomotora, y aquel calor es a su vez proporcionado por la energía química del carbón. Por su parte, el carbón consiste en los restos fósiles de plantas que vivieron hace millones de años y que se mantuvieron gracias a la luz del sol; y, según se ha descubierto, la energía del sol es de origen nuclear, liberada por reacciones atómicas que se producen en su interior.
A veces los físicos clasifican la energía en otros grupos, además de los seis que han sido descritos en el anterior ejemplo del ferrocarril.
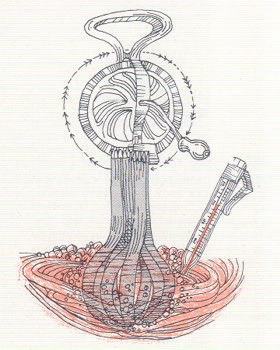
CÓMO CALENTAR UN HUEVO BATIÉNDOLO. Solamente con sus músculos y un batidor de huevos, el ama de casa simula los experimentos por medio de los cuales James Joule determinó el equivalente mecánico del calor. El más conocido de sus artificios es un peso que, al caer, hacía girar una rueda de paletas en el agua, calentando el agua por fricción. Gracias a este y otros experimentos determinó que 772 pies-libras de trabajo elevan 1° F la temperatura de una libra de agua. El ama de casa no puede comprobarlo pero consigue un aumento de la temperatura del huevo.
Esos grupos van desde tres a veinte, y pueden recibir diversos nombres; no obstante, para el objeto del presente libro consideraremos la energía según las seis formas principales que siguen más de cerca el uso tradicional.
De aquellas seis formas, la energía mecánica es quizás la más familiar; según el presente capítulo ha mostrado, es sencillamente la energía de un objeto en movimiento, la fuerza motriz que se halla tras toda maquinaria. Los pistones en movimiento de una máquina de vapor o de gasolina poseen energía mecánica y trabajan haciendo girar las ruedas. Aparece también en formas muy sencillas; un martillo, al descender para golpear un clavo, posee energía mecánica. Una piedra lanzada a través del aire posee energía cinética. Esa expresión viene de kinema, palabra griega que significa «movimiento», y que también ha inspirado nuestra moderna palabra «cinema» (es decir, imágenes en movimiento) y «kinescopio» (película obtenida de un programa de televisión).
Cuando un automóvil desciende por una cuesta posee, evidentemente, energía cinética, pero ¿qué decir del mismo automóvil, frenado, en lo alto de aquella misma colina? El físico admite que aquel automóvil tendría almacenada energía mecánica por razón de su posición en la colina. Si se soltasen los frenos se deslizaría hacia abajo, y podría producir mucho trabajo indeseable, es decir, daños, al pie de la colina. Así, pues, cuando se almacena energía mecánica se la llama energía potencial. En física clásica la energía cinética y la energía potencial son los dos aspectos de la energía mecánica. No obstante, en terminología moderna, con su mayor número de formas de energía, la palabra potencia se utiliza frecuentemente para designar cualquier clase de energía latente o almacenada.
La gravedad como fuente de trabajo
La gravedad crea con frecuencia energía potencial; cualquier objeto que se levante del suelo la contiene, y tan pronto como se le libera de lo que le retiene, la gravedad lo impulsa hacia abajo, y descenderá produciendo trabajo. El agua almacenada en un embalse es un ejemplo de depósito de energía potencial. A medida que sale del embalse pasa a través de turbinas y hace funcionar generadores eléctricos. Pero no toda la energía potencial depende de la gravedad; el muelle de un reloj en marcha, la cuerda tensa del arco de tiro, la cinta de goma estirada, todos ellos contienen energía almacenada que realizará un trabajo al ser liberada.
El calor es la segunda de las formas principales de energía. Si los pistones de una máquina de vapor hacen girar las ruedas, es debido al calor del vapor generado por una caldera llena de carbón ardiendo, que hace mover los pistones. Asimismo es el calor de la explosión de los gases en los bloques de los cilindros lo que hace funcionar un motor de gasolina.
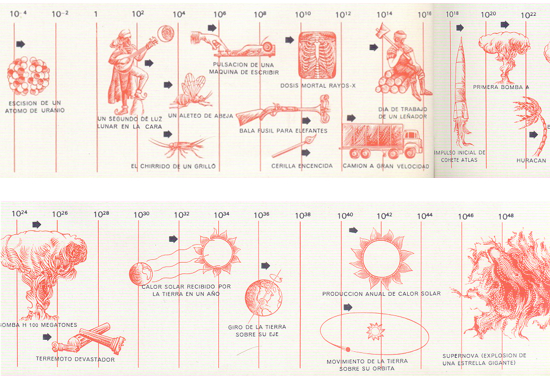
UNA ESCALA DE TRABAJO: GRILLOS, TERREMOTOS Y CAOS CÓSMICO. Cada una de los actividades representadas en la escala lleva consigo cierta cantidad de energía, mensurable en ergios (véase arriba). Las flechas indican valores aproximados. Para leer estos valores, añádanse tantos ceros a la unidad como indican las pequeñas cantidades exponenciales. Por ejemplo, 102 es igual o 100 ergios (1 seguido de dos ceros) y 1010 es igual a diez mil millones de ergios. Un signo negativo indica una fracción, de modo que 10-2 representa 1/100 de ergio.
La luz, o más exactamente la energía radiante, es la más pequeña forma de energía que apreciamos, la que nos es más difícil de observar en acción. Y, no obstante, llena el universo en cantidades tales, emitida por todas las estrellas semejantes a nuestro sol, que sus efectos acumulados son asombrosos. Aquí, sobre la tierra, todas las plantas verdes se mantienen gracias a la energía de la luz, y, evidentemente, toda la vida animal, incluso la del hombre, depende de las plantas para su alimento. Además de la luz, las ondas de radio, los rayos X, las ondas infrarrojas y ultravioletas, son todas ellas formas invisibles de energía radiante que el hombre hace trabajar. La radiación gamma, producto de lo que cae después de una explosión atómica y de otras formas de radiactividad, es una forma de energía radiante de efectos tan mortíferos que el hombre se ve obligado a contrarrestar y reducir al mínimo sus efectos.
La energía química es la energía de los alimentos y de los combustibles o, con más exactitud, la energía contenida en las moléculas químicas.
Con tres buenas comidas al día un hombre puede realizar mucho trabajo. Y la energía del carbón, de la madera, del petróleo y del gas, liberadas en forma de calor, hace funcionar motores y proporcionan calefacción.
La energía eléctrica es la de los imanes, de las corrientes eléctricas y combinaciones de ambos. La electricidad consigue efectuar su trabajo más discretamente que las otras formas de energía; así, por ejemplo, una corriente suficiente para accionar un motor de cinco caballos o para calentar una casa de cinco habitaciones puede ser transmitida indefinidamente por medio de un alambre de cobre de un espesor de la mitad de un lápiz.
La energía nuclear es la última y más peligrosa de las formas de energía identificadas por el hombre. Según su nombre indica, es la energía del núcleo del átomo, de las fuerzas que mantienen unida a la más pequeña de las partículas de materia. Hasta el presente sus usos han sido principalmente destructivos; causó las explosiones incontroladas de las bombas A y las bombas H, y puede liberar energía calorífica y mecánica capaz de quemar y pulverizar la tierra en una extensión de kilómetros. No obstante, es posible liberar lentamente esa energía en forma de calor, el cual puede ser utilizado para generar vapor con usos pacíficos, lo mismo que el carbón.
Estas breves definiciones sirven para recordar las complejas relaciones mutuas entre las diversas formas de energía. El ferrocarril citado más arriba no es sino uno de los numerosos ejemplos conocidos de todos. Consideremos la complejidad de otro caso: el agua de los lagos y de los océanos se evapora pasando a la atmósfera gracias al calor producido por la energía radiante del sol; el vapor se condensa en forma de nubes y luego cae como lluvia en lo alto de las montañas, Se desliza luego hacia abajo y hace girar los generadores de una fábrica de electricidad; la corriente resultante puede pasar a través de un alambre, yendo a encender una bombilla, a calentar una casa, o a cargar una batería química.
Una naturaleza por completo transformable
La facultad de interconversión de las diversas formas de energía es una de sus más importantes propiedades. Los físicos no pueden imaginar excepción alguna a la afirmación de que cualquier forma de energía puede ser, en último término, convertida en cualquier otra; a veces esas conversiones pueden parecer algo complicadas y forzadas. Así, por ejemplo, no se acostumbra a intentar la transformación directa de energía mecánica en calorífica, y, sin embargo, es posible, la fricción de dos bastoncillos puede ser suficiente para encender fuego. Asimismo, es casi imposible convertir directamente calor en energía eléctrica; lo que hace el hombre es utilizar el calor para accionar una turbina, cuya energía mecánica hace girar un generador que crea energía eléctrica. Debido a que la etapa mecánica intermedia es cara e ineficiente, los ingenieros están tratando de encontrar soluciones técnicas que permitan convertir directamente el calor en electricidad; existen ya dispositivos que lo efectúan, pero solamente a escala de laboratorio. La luz presenta también otro espinoso problema de conversión; si bien una cantidad prácticamente ilimitada de energía radiante incide sobre la tierra y se pierde, el hombre no dispone de ningún procedimiento verdaderamente eficaz para captarla para el trabajo. Solamente las plantas verdes de la tierra son capaces de hacerlo en gran escala, si bien actualmente se están comenzando a utilizar dispositivos de factura humana para utilizar la energía solar.
Quizás la transformación más difícil es la transformación de cualquier otra clase de energía en energía nuclear. Se produce, pero generalmente el físico atómico es el único testigo de tales transformaciones. Por ejemplo, en cierto experimento de laboratorio muy delicado, se ha observado que la luz volvía de nuevo a la sustancia del átomo. No obstante, incluso esa única transformación es suficiente para satisfacer a un físico. Todas las demás formas de energía pueden ser convertidas en luz, y se concibe que todas ellas puedan ser transformadas a la forma nuclear.
Los ingenieros actuales se enfrentan con la mayor naturalidad con todas estas complejas transformaciones de energía y saben, con una aproximación de unas cuantas calorías o vatios, exactamente cuánta energía necesitarán para efectuar un trabajo y la forma de energía que lo hará mejor y más barato.

LA FÁBRICA MÁS POTENTE DE TODAS. El sol, que aquí vemos justo antes de ponerse, es un horno atómico que convierte masa en energía. Cada segundo convierte 657 millones de toneladas de, de hidrógeno en 653 millones de toneladas de helio; las restantes cuatro millones de toneladas de masa son descargadas al espacio en forma de energía. La tierra recibe solamente una dos mil millonésima de aquella cantidad.
Y, sin embargo, esta familiaridad con la energía se basa en 200 años de experiencia solamente, casi toda ella obtenida desde que por vez primera Thomas Young definió la palabra en 1807.
Los restantes capítulos de este libro en parte recordarán cómo fueron identificadas las seis formas de energía en el transcurso de los años. La narración comienza en el capítulo 2.
La energía en la naturaleza: hermosa e ilimitada
El hombre vive en un océano de energía. A su alrededor, y sin cesar, la naturaleza está realizando trabajo, consumiendo energía en cantidades tan ilimitadas que el hombre solamente puede aprovechar una pequeña fracción.
El agua que desciende por los ríos podría suministrar suficiente fuerza hidroeléctrica para satisfacer el 80 % del consumo total humano de energía, pero de ella solamente se utiliza del 1 al 2 por ciento. Si se aprovechasen los vientos y las mareas, satisfarían la mitad de nuestras necesidades. La más colosal dínamo es el sol, fábrica de energía inconcebible e inmensa que afecta a todo lo que hay sobre la tierra. Si se juntasen todos los combustibles del mundo, se consumirían en cuatro días. En las páginas siguientes se encontrarán ejemplos de la fuerza en bruto de la naturaleza; el ensayo fotográfico final del libro muestra algunas de las, formas en que el hombre confía aplicar esta fuerza.
EL VIENTO
Frío o caliente, es portador caprichoso de venturas y desdichas
La atmósfera de la tierra actúa como gigantesca máquina térmica. Los rayos del sol más potentes en el ecuador que en las regiones polares, hacen que el aire tropical se caliente y se eleve mientras que el aire polar, más frío, se desplaza para sustituirlo.
La rotación de la tierra y las condiciones atmosféricas locales perturban constantemente el movimiento de esa corriente; el resultado es el viento. La acción conjunta de esas fuerzas, lo mismo puede crear un suave céfiro como generar las ráfagas de una galerna ártica o la espantosa y concentrada furia de un huracán de 800 kilómetros por hora como el representado aquí. El viento siempre ha sido una fuente de energía para el hombre. Durante siglos ha movido barcos de vela, ha extraído agua y ha molido grano.

UNA NUBE DE POLVO Y DESTRUCCIÓN. Un huracán, una de las fuerzas más destructoras que se conocen, alcanza la tierra en Scotts Bluff, Nebraska. El viento de los huracanes, al girar alrededor de un vacío parcial, puede levantar un edificio entero. En los Estados Unidos se forman unos 150 al año.
En el futuro los molinos de viento pueden convertirse en una importante fuente de energía eléctrica.
AGUA
Fuerza que fluye, muele y moldea la tierra.
Aproximadamente la tercera parte de la energía solar que alcanza la tierra se invierte en una empresa de asombrosas proporciones y de inmensas consecuencias para el hombre; cada año evapora y eleva 400.000 kilómetros cúbicos de humedad de los mares, ríos, lagos y corrientes.
| LA FUERZA DEL AGUA QUE RUGE. El río Zambeze fluye a razón de 100 millones de litros por minuto en las Cataratas Victoria, en África. Esta catarata de más de un kilómetro de ancho, situada entre Rhodesia del Norte y del Sur, tiene 50 metros más que la del Niágara. Cien millones de litros cayendo desde 100 metros equivalen a dos millones de caballos. |
Así, por ejemplo, el mar Mediterráneo pierde más agua por evaporación de la que le suministran todos sus tributarios, y se necesita una fuerte corriente del Atlántico para rellenar el vacío. Mucha de aquella humedad vuelve a caer sobre el océano, pero una tercera parte de ella desciende sobre la tierra en forma de lluvia, nieve, granizo y rocío, todo lo cual contribuye a formar los ríos, corrientes y glaciares que han proporcionado al hombre una importante fuente de energía. La arrolladora fuerza del agua en movimiento la evidencia el cálculo de que tres mil millones de toneladas de rocas son arrastradas a los océanos por las corrientes terrestres. La fuerza hidroeléctrica es la fuente de un quinto de la electricidad que se produce en los EE.UU. Por lo que se refiere a los glaciares, el terreno de toda la parte norte de los EE.UU. es testimonio de su monumental poder de abrasión, y lo mismo puede decirse de las cumbres de los Alpes.

LA MACIZA FUERZA DEL HIELO. Con increíble fuerza, el glaciar de Athabaska, en Alberta, Canadá, de once kilómetros de largo y más de uno de ancho, se abre camino arrastrándose entre Monte Athabaska, a la izquierda, y el Monte Kitchener. La mayor parte de los glaciares avanzan solamente unos cuantos metros a algunos centímetros por día.
EL MAR
Fuente inagotable de fuerza ondulante y de tesoros invisibles
Una magnífica reserva de energía se agita en los océanos que cubren el 70,8 % de la tierra; lo más evidente es la fuerza del viento y de la marea. Las olas, acumuladas por el viento, muerden, arrancan y trituran la costa, deshaciéndola en un punto y reconstruyéndola en otro.

ESCULTORAS DE LA COSTA. Olas procedentes del Atlántico Norte recortan el perfil rocoso del Cabo Wrath, en la costa noroeste de Escocia. Se ha calculado que durante los fuertes temporales la fuerza de las rompientes llega o ser de treinta toneladas por metro cuadrado. El viento y las olas han esculpido las torres gemelas de la Roca de lo Catedral, junto a la costo. Las olas impulsadas por el temporal tienen potencia para lanzar al aire peñascos y reducir edificios a añicos.
La marea, con sus idas y venidas dos veces al día, mantiene en constante movimiento infinidad de millones de toneladas de agua. Respondiendo a la atracción de la gravedad de la luna, y hasta cierto punto del sol, el ciclo de las mareas afecta también a la forma de la tierra. Pero en el océano hay aún mucha más energía de la que se ve a primera vista; encerrada en las moléculas del agua del mar se encuentra una fuente elemental de prodigiosa energía: el deuterio, átomo de hidrógeno pesado. La fusión controlada del deuterio, objetivo que la ciencia persigue ahora, haría del mar una fuente de energía que podría satisfacer nuestras demandas presentes durante mil millones de años. Otra fuente indirecta de energía es la vegetación del mar. Algún día las algas microscópicas, a razón de 100 kilos por hectárea, podrán proporcionar alimento inagotable a un mundo superpoblado.
EL CALOR DE LA TIERRA
Violentas erupciones que nos hablan del gran caldero subterráneo de la tierra
A menos de 65 kilómetros bajo la superficie de la tierra comienza una densa capa de rocas fundidas y gases, llamada magma.


UNA TORRE DE VAPOR. El Geiser Castillo surge en el Parque Yellowstone (izquierda), no lejos del famoso Amigo Fiel. En aquel distrito no ha habido volcanes desde hace miles de años, pero los 200 géiseres del parque liberan el calor suficiente poro fundir tres toneladas de hielo por segundo.
Esta masa fundida debe su existencia a tremendas presiones subsuperficiales y al calor creado por la desintegración energética de sustancias radiactivas. A veces este magma halla una hendidura en la corteza y estalla en forma de erupción. Los gases calientes actúan sobre las aguas subterráneas calentándolas y surgiendo al exterior en forma de géiseres.
Algunos vulcanólogos son de opinión que los volcanes deben haber producido todos los gases de la atmósfera, toda el agua de los océanos, y gran parte de la tierra sobre la que vivimos. Algunas de sus erupciones hacen pequeñas las explosiones atómicas. Cuando el Krakatoa estalló en el Pacífico en 1883, una montaña desapareció, se resquebrajaron paredes a 160 kilómetros de distancia, las olas producidas mataron a 36.000 personas, y el ruido se percibió a 4.500 kilómetros.

MONTAÑA DE FUEGO. Lava fundida brota de Kilauea Iki, en el Parque Nacional de Hawái, durante la espectacular erupción de 36 días en 1959. Algunos chorros de magma líquido fueron proyectados a 500 m. de altura. Tanta lava salió, que el lago resultante quizá tarde un siglo en enfriarse.
RELÁMPAGOS
Descargas deslumbradoras que recargan el planeta
La tierra es como una gran batería que hay que estar recargando siempre; cuando no hay nubes, la electricidad se va escapando de la tierra, negativamente cargada, pasando a la atmósfera superior, de carga positiva.

CHISPAS GIGANTESCAS EN LA NOCHE. Los relámpagos nocturnos restallan sobre Nueva York, reflejándose brillantemente en las nubes. Todas esas descargas no se produjeron simultáneamente, sino que se fotografiaron con una exposición múltiple de varios minutos. Como el relámpago se dirige al conductor más próximo, se utilizan pararrayos que protegen los edificios. Los rascacielos atraen al relámpago: el Empire State Building de Nueva York es alcanzado unas 20 veces cada año.
Esta pérdida la devuelven a la tierra las nubes tormentosas. Una nube puede acumular una carga eléctrica hasta 100 millones de veces más fuerte que la carga de la tierra que está justamente debajo. Los electrones se ven forzados a pasar de las nubes a la tierra, y cuando finalmente atraviesan el espacio forman el relámpago.
La tierra es alcanzada unas 100 veces por segundo por el rayo, el cual se precipita en franjas de 30 a 1.000 metros de longitud. Un solo relámpago puede desarrollar 3.750 millones de kilovatios, más que la suma total de la capacidad máxima de todas las fábricas de electricidad de los Estados Unidos. Pero como la descarga dura solamente una fracción de segundo, su energía vale solamente $7,50 a los precios nacionales. Aproximadamente el 75 % de la energía del relámpago se disipa en forma de calor, lo cual obliga al aire a dilatarse rápidamente, como los gases de una explosión, y ese movimiento crea las ondas sonoras que se oyen en forma de trueno a distancias de hasta 30 kilómetros.
Capítulo 2
Siguiendo la pista del calor

TOMANDO LA TEMPERATURA. Averiguar si una niña tiene fiebre es solamente una de las maneras en que el termómetro ha servido al hombre desde que lo inventó Galileo hace más de 350 años. Al proporcionar la manera de medir la intensidad del calor hizo posible que los científicos de los siglos XVIII y XIX explorasen y comprendiesen su naturaleza.
«Hace diez años, escribió Daniel Gabriel Fahrenheit en 1724, en la "Historia de las Ciencias”... que el famoso (Guillaume) Amontons, utilizando un termómetro de su invención, había descubierto que el agua hierve a un grado fijo de calor. Yo me sentí inmediatamente inflamado por un gran deseo de construirme un termómetro semejante, para poder percibir con mis propios ojos tan hermoso fenómeno de la naturaleza y con convencerme de la verdad del experimento.»
Para satisfacción de todos aquellos a quienes preocupa el tiempo, Fahrenheit no solamente se propuso reproducir el instrumento de Amontons, sino que su esfuerzo por mejorarlo proporcionó a la humanidad el primer termómetro digno de confianza, e hizo posible el estudio sistemático de la forma de energía llamada calor.
El Primer Paso Tras la Temperatura |
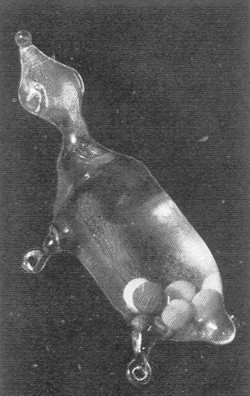
Por muy raro que parezca en estos días de termómetros baratos y de partes meteorológicos continuos, en fecha tan reciente como el siglo XVIII no existía manera de medir con precisión grados de calor y de frío. Nadie podía estar seguro de cuánto más caluroso era un día que otro, excepto por el uso de sus sentidos. Así un médico tenía que juzgar el grado de fiebre de su enfermo palpándole la frente, de la misma manera que los buenos cocineros utilizaban su experiencia del fuego para juzgar la temperatura de los hornos. Los científicos, incapaces de prosperar en el mundo de las adivinanzas, se sentían más frustrados que los demás porque, hasta que Fahrenheit resolvió su problema, no poseían ningún instrumento satisfactorio con que penetrar los misterios del calor. A principios del siglo XVII comenzaron unos esfuerzos rudimentarios para medir variaciones de frío y calor, cuando Galileo Galilei ideó el termómetro que aparece en la página siguiente. «Galileo tomó un recipiente de vidrio del tamaño de un huevo de gallina, lo unió a un tubo del grosor de una paja y de unos dos palmos de largo, dice el informe de un alumno, calentó la ampolla con las manos y dio una vuelta al revés al cristal, de modo que el tubo pudiera ser sumergido en agua contenida en otra vasija. Tan pronto como la ampolla se hubo enfriado, el agua se elevó en el tubo hasta la altura de un palmo por encima de su nivel en la vasija. Utilizó este instrumento para investigar grados de frío y de calor.»
Poco se sabe de la escala de medidas de Galileo, salvo una mención en sus Diálogos, de seis, nueve y diez grados de calor, pero su aparato sirvió a otros como punto de partida. Unos investigadores encontraron que la presión del aire, al variar con la altura y las condiciones del tiempo, afectaba de tal manera la altura de la columna que rara vez era digna de confianza para medir la temperatura. Intentando evitar tal inexactitud, un médico francés llamado Jean Rey, invirtió la disposición de Galileo, llenando la ampolla de agua y el tubo de aire, y observando luego la expansión del líquido como medida de la temperatura. Las manos de un enfermo de fiebres, dijo Rey, hacían que el agua en el tubo fluctuase reflejando el calor del cuerpo.
El instrumento de Rey era inexacto, porque la evaporación del agua por la parte superior abierta del tubo afectaba la altura del agua. Un gran duque de Toscana, Fernando II, en su intento de construir un artificio mejor, dirigió a unos miembros de su Academia del Cimento en una serie de experimentos, en sus famosos laboratorios florentinos. Utilizaron espíritu de vino, un alcohol bruto, en lugar de agua, sellaron el extremo del tubo y marcaron grados con cuentas de vidrio; pero incluso la dedicación de aquellos académicos resultó insuficiente.
Lo que a todos los instrumentos primitivos les faltaba era una escala de medida clara, con un punto alto y un punto bajo basados en algún fenómeno natural que ocurriese siempre a la misma temperatura, a presión atmosférica constante. Los florentinos habían elegido el frío del invierno y el calor del verano para sus puntos bajo y alto. Por frío del invierno dijeron que entendían la temperatura de la nieve o del hielo en la helada más rigurosa, y para calor del verano utilizaron la temperatura de una vaca o de un ciervo. Otro termometrista primitivo tomó otros dos puntos igualmente inciertos: la temperatura del aire durante la helada como punto bajo, y la de la fusión de la mantequilla como punto alto.
Le estaba destinado a Fahrenheit escoger un punto alto y otro bajo, que si bien no eran perfectos, por lo menos estaban a pocos grados de ser invariables. Como punto bajo eligió la temperatura de una mezcla «frigorífica» de hielo, agua y sal. Como alto escogió la temperatura de un hombre sano, al cual asignó arbitrariamente el número 96 (cantidad fácilmente divisible), en lugar de 98,6 °F como la consideramos hoy. Utilizando mercurio como fluido dilatable, determinó que el hielo puro fundía a 32 °F y, extendiendo hacia arriba su nueva escala, pudo calcular que el agua hervía a 212 °F. «Aunque quizás imperfecto en muchos sentidos, dijo modestamente Fahrenheit, el resultado ha satisfecho mis deseos, y con gran placer mental he observado la verdad de la cosa».
Una escala vuelta al revés
Fahrenheit había establecido criterios de calor y de frío que otros iban a perfeccionar. En 1730 R. A. F. de Réaumur propuso una escala que todavía se usa a veces en Europa y que divide en 80 grados el intervalo entre la ebullición y la congelación. Doce años más tarde Anders Celsius de Suecia sugirió tomar el cero como punto de ebullición y 100 como congelación, escala a la que pronto se le dio la vuelta, poniendo la ebullición a 100° y la congelación a 0°.

NACIMIENTO DEL BARÓMETRO. Evangelista Torricelli, discípulo de Galileo, inventó el barómetro de mercurio, pero murió en 1647 sin haber demostrado su utilidad. Un año más tarde, su cuñado, Florin Périer, experimentó con el instrumento (arriba) en las laderas del Puy-de-Dôme, en las montañas de Auvernia, Francia. Observó que la columna de mercurio iba descendiendo al aumentar la altura, demostrando con ello que el barómetro servía para medir la presión atmosférica.
Además de hacer la vida menos complicada para todos los científicos, estos refinamientos, que dieron por resultado la escala ahora llamada centígrada o Celsius, también proporcionaron un sencillo instrumento de medida para ciudadanos medios de todo el mundo, excepto en los Estados Unidos y en algunas naciones de la Comunidad Británica, únicos países del mundo que aún se aferran a la engorrosa escala de Fahrenheit. Existe, además, otra escala de temperaturas muy usada por los científicos, quienes se dieron cuenta de que si el frío es sencillamente la ausencia de calor, se deduce que debe haber un punto donde no hay absolutamente ningún calor. Este concepto determinó en 1848 el desarrollo de la escala de Kelvin, así llamada en honor del gran físico inglés lord Kelvin. El cero de la escala de Kelvin es el equivalente a -459,7 °F y a -273 °C y es la temperatura más fría posible que puede obtenerse en el universo.
El químico británico sir Humphry Davy dijo en una ocasión que el desarrollo de este nuevo instrumento era el factor más importante para el progreso de la teoría científica, y no hay duda de que el termómetro ha contribuido a abrir más nuevas sendas a los exploradores científicos que cualquier otro instrumento. En esa vanguardia se encontraba un químico escocés llamado Joseph Black, quien fue luego mentor de James Watt y le condujo indirectamente a idear su máquina de vapor. En sus experimentos con el termómetro de Fahrenheit, el primero y más fundamental descubrimiento de Black fue el de que calor y temperatura no son lo mismo. Visto desde el siglo XX, este descubrimiento puede no parecer demasiado revolucionario, pero ninguno de los contemporáneos de Black había conseguido establecer una distinción clara entre los dos conceptos.
Guiso de disco de hierro
En efecto, Black demostró lo que ocurre cuando se coloca un disco de hierro sobre un hornillo de cocina y al mismo tiempo se pone una cacerola con agua, del mismo tamaño que aquél, sobre otro hornillo. Si durante 10 minutos se suministra la misma cantidad de calor en ambos hornillos, el hierro se calienta tanto que quema al tacto, mientras que el agua permanece tibia, igual calor ha producido temperaturas diferentes. Black dedujo que el calor es evidentemente una cantidad de algo, mientras que la temperatura es el grado de calor.
Black ensayó su teoría con numerosas sustancias y halló que cada una de ellas requiere una cantidad diferente de calor para elevar su temperatura un grado. A esta propiedad de las sustancias la llamó «capacidad para el calor». Más tarde los científicos atribuyeron arbitrariamente la cantidad «uno» a la capacidad para el calor del agua, y ahora la capacidad de otros materiales para absorber calor se compara con aquella cifra y se le llama «calor específico». Ahora sabemos que el hierro a la temperatura ambiente tiene un calor específico de 0,107, lo cual significa que para elevar la temperatura del hierro, un grado se necesita sólo aproximadamente la décima parte de lo requerido para elevar un grado la temperatura de una cantidad igual de agua. Es curioso que el calor específico de casi todos los gases, metales y sólidos que han sido ensayados hasta ahora ha resultado ser menor que el del agua. Solamente dos líquidos tienen un calor específico superior, el amoníaco, con 1,125, y el éter, que llega a 1,041 solamente por encima de 180 °C. Eso significa que, comparada con casi todas las demás sustancias, el agua es lenta en absorber y en perder calor.
Si bien la aptitud del agua de retener calor no sorprenderá a nadie que haya usado una botella de agua caliente en la cama, pocas personas aprecian el importantísimo fenómeno en virtud del cual el relativamente elevado calor específico del agua modera la temperatura de la tierra y hace que la mayor parte de ella sea habitable. Como el 73 % de la superficie del globo está cubierta de agua, inmensas cantidades de calor solar son absorbidas en verano por los océanos y aguas interiores y devueltas lentamente a la atmósfera en invierno. Ese efecto moderador se percibe en cualquier parte del mundo donde las temperaturas varían durante el año, pero es especialmente perceptible en las costas.
| UN TERMÓMETRO PRIMITIVO. Sanctorius, profesor de Medicina en Padua en el siglo XVII, inspirado por el termoscopio de Galileo, lo adoptó convirtiéndolo en el primer termómetro médico. Al respirar el enfermo sobre lo ampolla (arriba), el aire del interior se calentaba, se dilataba e impulsaba hacia abajo el agua del tubo. Sanctorius midió las variaciones de temperatura del cuerpo de sus enfermos por medio de una rudimentaria escala que se basaba en el calor de la llama de uno bujía y el frío de la nieve. |
Así el Océano Atlántico junto a la costa de Coney Island rara vez llega a más de 21 °C en agosto o a menos de 13 °C en enero. Por eso Coney Island tiende a tener temperaturas moderadas, más frescas en verano y más calientes en invierno, de lo que ocurriría de no ser así. Las lozanas huertas de las orillas de los Grandes Lagos dependen del mismo principio; los árboles y las vides se mantienen vivas durante el invierno, mientras que solamente unos cuantos kilómetros al norte o al sur, todas las plantas, salvo las más resistentes, sucumben al duro frío del norte.
En busca de lo que es caliente
En su estudio de vanguardia investigando el calor, Joseph Black utilizó el termómetro para penetrar en muchos fenómenos que hasta entonces habían resultado incomprensibles.
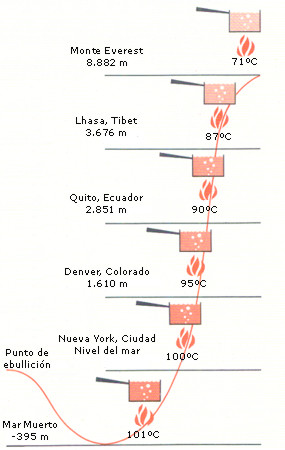
| BAJA PRESIÓN EN CACEROLA ALTA. El agua hierve cuando, al calentarla, la presión de las moléculas que se escapan de ella iguala a la de la atmósfera. Cuanto más se sube, tanto más baja es la presión atmosférica y, por consiguiente, tanto menor la temperatura a que hierve (derecha). Esto significa que, aun cuando el agua esté hirviendo, los alimentos reciben menos calor, tardando más tiempo en cocerse en los sitios altos. Un huevo hirviendo tres minutos en el Everest está casi crudo. |
A sus predecesores les había parecido lógico, y la verdad es que sigue pareciéndolo hoy en día, que si se deja una caldera con agua encima de un hornillo, debería calentarse cada vez más, y que al llegar a la ebullición su temperatura debería continuar aumentando hasta haberse evaporado toda el agua. Utilizando su nuevo termómetro en su propia caldera, Black determinó lo que ocurre en realidad: el agua deja de ponerse más caliente en cuanto alcanza 100 °C, pero sigue hirviendo.
Black también determinó que una mezcla de hielo y de agua permanece a la misma temperatura, aunque se añada o quite calor, hasta que se ha transformado por completo en agua o en hielo. Así se explicó por qué la nieve amontonada a los lados de una carretera puede resistir el sol incluso mucho tiempo después de que el resto de la nevada se ha fundido, así como por qué la temperatura de una bebida helada permanece a la de fusión del hielo mientras queda algo de éste.
Al observar cómo se fundía el hielo y se evaporaba el agua, Black se dio cuenta de que estos cambios en el estado físico del agua requerían calor. Su conclusión fue que el agua en forma de hielo permanece sólida a 0 °C porque le falta la cantidad suficiente de calor para transformarse en líquido. Dedujo también que el agua nunca se calienta a más de 100 °C porque a esta temperatura utiliza por completo todo el calor disponible para el proceso de transformarse de líquido en gas. Para el proceso inverso, cuando el agua se transforma de líquido a sólido, Black sentó la hipótesis de la presencia de lo que llamó «calor latente». Pensó que para que el agua se helase era necesario quitar el calor latente, que es el fenómeno que ocurre cuando un refrigerador en funcionamiento expulsa aire caliente.
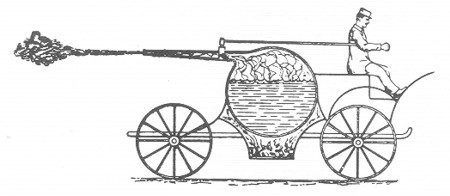
VEHÍCULO A CHORRO DEL SIGLO XVII. Este carruaje de cuatro ruedas propulsado por un chorro de vapor que sale por una boquilla dirigida hacia atrás, fue propuesto como ilustración de la tercera ley del movimiento de sir Isaac Newton, que dice que lo acción y la reacción son de igual magnitud y de sentido opuesto. Esta máquina no fue nunca construida, pero podría haber funcionado si la boquilla hubiese sido lo suficientemente estrecha para determinar una presión suficiente, y si hubiese llevado cojinetes de bolas en las ruedas.
«Mi conjetura, puesta en práctica, era como sigue, escribió Black. Imaginé que durante la ebullición el calor es absorbido por el agua y entra en la composición del vapor producido, de la misma manera que es absorbido por el hielo al fundirse, y entra entonces en la composición del agua producida.»
Joseph Black fue sólo uno de los muchos científicos europeos de talento que contribuyeron al conocimiento creciente del calor. En 1787 un físico parisino, Jacques Charles, demostró que todos los gases mantenidos a presión constante se dilatan en proporción a la cantidad de calor aplicado. Semejante conclusión fue alcanzada independientemente en 1802 por otro francés, Joseph Louis Gay-Lussac, y la ley resultante sobre el comportamiento de los gases se acredita a veces a uno y a veces al otro.
Cuando un gas caliente se dilata, se hace menos denso y más ligero que uno frío, y, por lo tanto, tiende a subir. Este efecto es muy perceptible en una habitación calentada, cuando a veces se siente aire frío en los pies, mientras que el aire alrededor de la cabeza es perfectamente confortable. Esa es la razón por la cual el aire caliente, al subir por una chimenea, crea una corriente de aire frío que entra precipitadamente para ocupar su lugar. Por la misma razón el humo sube por las altas chimeneas en lugar de caer al suelo. Y lo que es aún más importante, la expansión del gas es el principio fundamental de las máquinas de vapor y de gasolina.
El proceso es sencillo; cuando se introduce un gas caliente, como el vapor, en la cámara de un pistón, su calor es tan grande que su expansión impele el pistón en la cámara hacia atrás, y este movimiento tiene un enganche para que haga girar el cigüeñal y éste a su vez las ruedas. La misma energía de movimiento se produce cuando se hace estallar gasolina por medio de bujías de ignición en las cámaras de los pistones del automóvil. Los gases calientes así inflamados se dilatan empujando hacia fuera los pistones, proporcionando al automóvil la fuerza necesaria para moverse a la velocidad deseada. Los dispositivos de esta naturaleza, que convierten energía calorífica en energía mecánica, se llaman «máquinas térmicas».
El calor y el péndulo
Los estudios de dilatación demostraron también que la mayor parte de los líquidos y de los sólidos, así como todos los gases, se dilatan al aumentar la temperatura, y que la cantidad de expansión por cada grado que aumenta la temperatura depende de la sustancia.
| SUBIENDO COMO EL HUMO. Este ornamentado globo transportó a Pilâtre de Rozier y al Marqués D’Arlandes sobre París el 21 de noviembre de 1783; fue el primer vuelo del hombre. El globo recibió su empuje ascendente del humo de un fuego de lana, carbón y paja, utilizando el principio de que el aire caliente, al dilatarse, pesa menos que el aire frío. Una vez en el aire el globo contaba con su propio aire caliente gracias al fuego de un brasero, A, que los aeronautas cuidaban o través de ventanillas, C, desde su galería, B. |
Por ejemplo, debido a que la dilatación térmica del metal o de los plásticos es mayor que la del vidrio, las amas de casa con frecuencia vierten agua caliente sobre las tapas metálicas de los alimentos envasados en frascos, o sobre los tapones de plástico de las botellas de esmalte para las uñas. Este calentamiento de las tapaderas hace que el metal o el plástico se dilaten aflojando su presión sobre el envase.
Por la misma razón el calor tiende a hacer que los péndulos de los relojes se alarguen, y es por eso que los verticales de pie retrasan en tiempo caluroso, a menos de que sean corregidos.
La dilatación es de gran importancia técnica porque frecuentemente obliga a los ingenieros a tomarla en consideración en muchos materiales estructurales. Un kilómetro de vía de ferrocarril se dilata hasta medio metro en el calor del verano; las hendiduras entre las secciones de carril sirven para compensarla. Asimismo, un puente de metal de 300 metros de largo puede variar de longitud unos veinte centímetros. Y, a pesar de que a pocos habitantes de Nueva York les preocupe, el calor del verano hace que los cables del puente de Brooklyn se alarguen, al mismo tiempo que el piso de la carretera se dilata, encorvándose. Este problema fue previsto por los ingenieros, quienes idearon una unión central telescópica, que permite un movimiento de unos treinta centímetros.
Tres extraños fenómenos, calor específico, calor latente y la dilatación ordenada de gases y otras sustancias, fueron descubiertos en rápida sucesión después de la invención del termómetro. Para explicarlos, los científicos adoptaron un antiguo concepto que más tarde había de ser conocido como teoría del calórico y cuya base era la creencia de que el calor era un fluido invisible llamado calórico, y que cuando se calentaba una sustancia cualquiera el fluido penetraba en ella, y cuando se enfriaba salía de ella. Después de los descubrimientos de Black, esa idea básica fue refinada y desarrollada de tal manera que explicaba adecuadamente todos los fenómenos del calor conocidos por aquella fecha.
He aquí sus postulados esenciales según se formularon en 1779:
- El calórico es un fluido elástico cuyas partículas se repelen unas a otras.
- Las partículas del calórico son fuertemente atraídas por las partículas de otras materias y diferentes clases de materia atraen el calórico con fuerza diferente.
- El calórico es indestructible y no puede ser creado.
- El calórico puede ser sensible o latente (p. ej., puede sentirse o estar almacenado), y en este segundo estado está combinado «químicamente» con partículas de materia, transformando un sólido en líquido o un líquido en vapor.
- El calórico no tiene peso apreciable.
Los caloristas hacen equilibrios
Es fácil de ver que esa teoría funcionaba muy bien. Que las partículas de calórico eran atraídas por las partículas de otra materia, explicaba por qué se calentaban las cosas; que se repelían unas a otras; explicaba por qué la mayor parte de las cosas parecían dilatarse cuando estaban llenas de calórico. Puesto que formas diferentes de materia pueden atraer calórico con fuerzas diferentes, diferentes sustancias pueden absorber diversas cantidades de calor, es decir, tienen valores específicos distintos. El calor latente se explicaba como una combinación química del calórico con las partículas de materia, produciendo un nuevo estado de la materia. Según esta teoría, el agua no era sino hielo combinado con calórico; el vapor era agua combinada con aún más calórico. La necesidad de afirmar que el calórico carecía de peso se presentó después que los adversarios de la teoría hicieron notar que, si el calórico realmente existía, un objeto debería pesar más cuando estaba caliente que cuando estaba frío; por más que se intentó, no fue posible observar diferencia alguna, de modo que los caloristas sencillamente revisaron su teoría afirmando que el calórico no tenía peso.
| LA FUERZA DE TRES BUJÍAS. Esta decoración navideña muestra una de las maneras en que el calor realiza trabajo. |
La teoría que se presentaba en oposición a la del calórico no pareció nunca tan sencilla, y tardó mucho tiempo en desarrollarse. Ya en 1620 sir Francis Bacon había dicho categóricamente: «El calor en sí mismo, en esencia, es movimiento y nada más». El famoso físico inglés Robert Boyle había descrito el calor a su amigo Robert Hooke diciendo que no era «nada más que una agitación muy rápida y vehemente de las partes de un cuerpo». En el siglo XVIII John Locke se había unido al creciente coro, y medio siglo más tarde, en el punto culminante del entusiasmo calórico, la opinión de que se trataba de un movimiento fue adoptada por Benjamín Thompson, un americano que había abandonado las colonias y había entrado al servicio del Elector de Baviera, ascendiendo rápidamente hasta convertirse en consejero con el título de Conde Rumford.
Rumford demostró, por medio de una serie de precisos experimentos, que no había alteración en el peso de un líquido tanto cuando se sustraía como cuando se añadía calor.
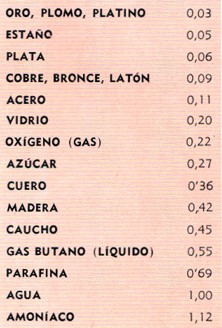
COMPARACIÓN DE CALORES ESPECÍFICOS. El calor específico de uno sustancio es el calor necesario para elevar cierto volumen de una sustancia un número determinado de grados de temperatura. Suele expresarse en calorías por gramo por grado centígrado, como en la tabla. El calor específico varía algo según la temperatura inicial del material, los valores indicados son los correspondientes a 15 °C. Cuanto mayor es el calor específico de un material, más tarda en calentarse, más calor mantiene y más tarda en enfriarse. |
|
Así, por ejemplo, determinó que el agua ni ganaba ni perdía peso cuando pasaba a los estados sólido o líquido, o inversamente. Pero si bien se ocupaba del efecto del calor en el peso, su mayor contribución fue la convicción de que el movimiento que producía fricción era la fuente del calor.
El conde y el cañón
Mientras dirigía el calibrado de cañones de bronce para el ejército de Baviera, llamó la atención a Rumford la gran cantidad de calor que se producía durante la perforación. Sabía que los caloristas atribuían aquel calor a la salida de calórico presente en cualquier sustancia, en este caso en el bronce, por la acción del taladro, y afirmó que si esa teoría era correcta debería haber menos calórico en las virutas que en el mismo peso de bronce macizo, puesto que se había producido una gran cantidad de calor durante la conversión. «Pero no había ocurrido tal variación, dijo Rumford. No había habido disminución del calor específico durante el vaciado que había convertido el centro del cañón en un montón de virutas.» Hizo observar que «la parte de agua en la cual se pusieron las virutas (calientes) no se calentó ni más ni menos que la otra porción en la cual se pusieron los restantes fragmentos (igualmente calientes y macizos) de metal».
«¿Qué es calor?, Rumford preguntaba en un tratado que escribió sobre sus experimentos. ¿Existe algo así como un fluido ígneo? ¿Existe alguna cosa que pueda ser propiamente llamada calórico?»
Su respuesta fue negativa. Dispuso una caja llena de agua ajustada alrededor del extremo del cañón y presionó contra él un taladro de acero; a medida que el cañón giraba lentamente contra el taladro, la fricción iba calentando el bronce, el cual a su vez calentaba el agua que lo rodeaba. Al cabo de dos horas y media de taladrar, el agua hirvió; Rumford más tarde describió el asombro de los espectadores al ver agua que hervía «sin fuego».
Afirmó que, puesto que el calor parecía sea inagotable, «no podía ser en modo alguno una sustancia material; y a mí me parece muy difícil, por no decir imposible, imaginar algo capaz de ser excitado y comunicado a semejanza del calor en estos experimentos, como no sea MOVIMIENTO». Rumford llegó a la conclusión de que la fuente del calor era el movimiento.
Hielo más hielo, igual a calor
Las observaciones de Rumford sobre el vaciado de cañones fueron confirmadas en experimentos independientes efectuados por Humphry Davy, quien alcanzó gran distinción como conferenciante de química en la Royal Institution de Londres.
TRES MANERAS DE CALENTARSE: COMO SE MUEVE EL CALOR


CALOR POR CONDUCCIÓN (izquierda): El método más sencillo de transmitir calor es por contacto directo, o conducción. La botella de goma para agua caliente transmite el calor, confortando el estómago de esta dama. CALOR POR RADIACIÓN (centro): Aunque mucho calor se escapa por la chimenea, este caballero puede calentar su parte posterior por radiación, rayos infrarrojos emitidos por el fuego, el carbón y las piedras del hogar. CALOR POR CONVECCIÓN (derecha): Las líneas anaranjadas indican corrientes de convección, formadas por aire caliente que, el dilatarse, se levanta desde el suelo, deshelando a este aterido patinador.
Utilizando maquinaria ideada por él, Davy produjo fricción en el vacío fundiendo así la cera, a pesar de que la temperatura estaba por debajo de la de congelación. Se dice que también fundió hielo en un crudo día de invierno, frotando dos pedazos de hielo uno contra otro, a fin de demostrar que el calor requerido para la fusión se creaba por el movimiento. A pesar de que el uso que hizo del hielo para crear calor por fricción podría parecer prueba evidente de que el calor es movimiento y no calórico, casi tuvo que transcurrir medio siglo antes de que la naturaleza del calor volviese a ser investigada por J. Robert Mayer en Alemania y James Prescott Joule en Inglaterra.
A esos dos hombres es a quienes principalmente debemos las ideas que condujeron al moderno concepto del calor; y es a ellos a quienes debemos la moderna doctrina científica de la conservación de la energía. Hasta aquel tiempo el concepto de la conservación de la energía se limitaba a transformaciones puramente de índole mecánica que afectaban a objetos en movimiento.
Mayer ejerció durante algún tiempo su profesión de médico en la isla de Java, donde observó que la sangre de las venas de sus enfermos javaneses presentaba un color rojo brillante, que generalmente se encontraba tan sólo en la sangre de las arterias, que es muy oxigenada. Pensando sobre ese hecho, en 1840 llegó a la conclusión de que en los climas calientes el cuerpo necesita menos oxidación para mantener su temperatura normal que la requerida en un clima más frío. Esa observación le condujo a su gran idea intuitiva de que la energía del mundo es constante. En su publicación en 1842, «Observaciones sobre las fuerzas de la naturaleza inorgánica», indicó las líneas generales de su nueva teoría, afirmando que «cuando una fuerza (término con que entonces se designaba a la energía) llega a existir, no puede ser destruida, en modo alguno; solamente puede cambiar de forma».
Utilizando los datos experimentales disponibles sobre el calor necesario para mantener la temperatura del aire en dilatación, Mayer consiguió calcular con bastante aproximación la cantidad de trabajo mecánico equivalente a una cantidad de calor, a pesar de que le faltaba formación científica, así como oportunidades para realizar trabajo experimental. Joule, por otra parte, contribuyó a la teoría mecánica del calor y al concepto de la conservación de la energía basándose en datos obtenidos por medio de cuidadosas investigaciones científicas.
Tanto Mayer como Joule habían afirmado que el calor podía ser transformado en trabajo mecánico, y el trabajo mecánico en calor. Independientemente, los dos habían proclamado que existe en la naturaleza un principio que no puede, en ningún caso, ser destruido, pero que en diversas circunstancias puede ser transformado. Con el calor y el trabajo mecánico como representantes de tal principio, tanto Mayer como Joule habían calculado, partiendo de datos diferentes, la cantidad exacta de trabajo necesaria para crear un incremento de calor.
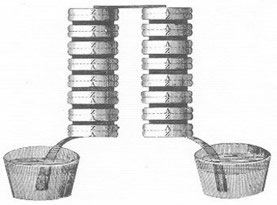
Joule efectuó un experimento tras otro; convirtió electricidad y energía mecánica en calor, de diversas maneras, como por calefacción eléctrica, agitación mecánica y compresión de gases. Para uno de estos experimentos Joule ideó un recipiente aislado en cuyo interior unas ruedas de paletas batían agua. Como mecanismo propulsor, y para calcular la energía potencial utilizada para hacer girar dichas paletas, utilizó pesos de caída lenta, como los de un reloj vertical de pie. Determinó su equivalente mecánico del calor calculando cuántas libras habían de caer desde cierta altura para elevar la temperatura de cierto volumen de agua un número determinado de grados. Después de más de treinta años de ensayos y tanteos, su respuesta final, que fue 772 pies-libra, es notablemente próxima a la cantidad de 778 pies-libra de trabajo, que ahora sabemos es lo necesario para elevar un grado Fahrenheit la temperatura de una libra de agua.
Hace mucho tiempo que el hombre sabe que el trabajo puede ser convertido en calor en un sinnúmero de maneras. Se produce al frotarse las manos en un frío día de invierno; un boy scout consigue elevar la temperatura frotando dos palitos cuando intenta encender el fuego. Incluso Platón, hace 24 siglos, descubrió que «el calor y el fuego, que engendran y mantienen otras cosas, según dijo, son a su vez generados por impacto y fricción». Pero fue Joule quien, partiendo de la base establecida por Rumford y Davy, demostró experimentalmente las ideas de Mayer haciendo irrecusable la teoría de la equivalencia. Joule había citado a Davy con su fusión de hielo en un ambiente por debajo del de congelación, como argumento contra la teoría del calórico. No solamente rebate posibles argumentos de los caloristas en el sentido de que el calor lo suministraba la atmósfera circundante, sino que también apoya la doctrina de la inmaterialidad del calor, puesto que la capacidad calorífica del hielo es menor que la del agua y, por lo tanto, el hielo no pudo haber proporcionado el calórico para la fusión. Davy tenía, pues, buenas razones para inferir que «la causa inmediata del fenómeno del calor es el movimiento». Hacia la segunda mitad del siglo XIX se había ya establecido sin lugar a grandes dudas que el calor no es una sustancia o un fluido independiente, sino que es energía cinética, y que se presenta de muchas maneras, a consecuencia del movimiento de pequeñas partículas de materia ordinaria.
Una vez se hubo demostrado que el calor es una forma de movimiento y, por lo tanto, una forma de energía, se comprobó que el consumo de una cantidad determinada de trabajo siempre ocasionaba la producción de la misma cantidad de calor. La equivalencia del trabajo y del calor se ha incorporado en la Primera Ley de Termodinámica, avance significativo en dirección de una descripción unificada de nuestro universo.

UNA ASCENSIÓN MEDIDA. En 1804 el gran químico francés Joseph Louis Gay-Lussac y un colega ascendieron a 400 metros en un globo y efectuaron medidas de gases en el aire superior. Además de una colección completa de barómetros, termómetros y aparatos para medir la electricidad y el magnetismo, llevaron ranas, insectos y pájaros para estudiar su comportamiento a alturas elevadas.
Medidas: hombres y hechos históricos
En un mundo donde un interruptor o un botón pueden convertir en fácil un trabajo difícil, las unidades científicas como el caballo de vapor o la caloría, el voltio y el watio son palabras de uso corriente.

RÉAUMUR Y SUS EXTRAÑOS TERMÓMETROS. Los holandeses y los ingleses fueron los primeros en adoptar los termómetros de mercurio de Fahrenheit. Pero en Francia, R.A.F. de Réaumur, naturalista y matemático que desconocía el trabajo de Fahrenheit, creyó inadecuado el mercurio porque sus pequeñas reacciones a los cambios de temperatura eran difíciles de medir; construyó los toscos termómetros de alcohol representados arriba, y dividió la escala en 80 grados entre los puntos de congelación y de ebullición del agua. Su escala de 80° todavía se utiliza en Alemania.
Pero no hace sino 150 años que los científicos comenzaron a medir cosas tales como la fuerza del vapor, y más tarde la fuerza de una corriente eléctrica.
Ciertas invenciones de los siglos XVIII y XIX, como el termómetro y la máquina de vapor, la batería y el circuito eléctrico, habían creado repentinamente la necesidad de nuevas medidas. Las páginas siguientes nos hacen retroceder a los orígenes de las modernas medidas, y representan las máquinas e instrumentos que fueron en su día hitos en la marcha del progreso del hombre. Volta, Watt y Fahrenheit personificaban un espíritu científico resumido por lord Kelvin: «Cuando se puede medir aquello de que se habla, y se puede expresar en números se sabe algo de ello».
Una colección de chismes para medir el frío y el calor
Hacia 1592, Galileo construyó el primer aparato para medir temperaturas, pero pasaron más de 125 años antes de que el físico alemán Daniel Gabriel Fahrenheit presentase el primero que era exacto. Entre aquellos dos hubo termómetros de todas formas y medidas. Eran tubos de vidrio en los cuales unos líquidos subían o bajaban al variar la temperatura.
| DANDO VUELTAS A LA TEMPERATURA. Este termómetro en espiral, construido en 1657 por un soplador de vidrio florentino, era tan sensible que solamente respirando sobre la ampolla inferior el alcohol subía por los anillos. |
Los primitivos fabricantes de termómetros tenían sus dificultades; no estaban de acuerdo sobre si lo mejor era agua, mercurio o alcohol; y sus rudimentarios termómetros rara vez indicaban la misma temperatura en el mismo lugar. Además, cada uno parecía utilizar una escala diferente. En el siglo XVIII había en uso unas 19 escalas diferentes basadas en "normas" como el punto de fusión de la mantequilla y el frescor de una bodega de París.
Las tres de uso corriente hoy en día, Fahrenheit, centígrada y Réaumur, todas utilizan mercurio y los puntos de ebullición y congelación del agua como referencia. Pero la última palabra en termómetros es la escala de Kelvin, por medio de la cual se miden los extremos máximos del frío y del calor.
DIFERENCIAS DE GRADO |
|
| RANA FRÍA Y CALIENTE. Este termómetro de rana, del siglo XVII, lleva siete bolas vacías de diferentes pesos flotando en alcohol; al aumentar la temperatura las bolas iban hundiéndose. |


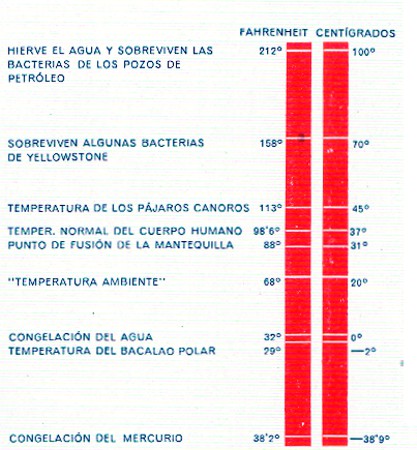
ESCALA PARA LOS ÚLTIMOS CONFINES. Se muestra la escala de Lord Kelvin de temperaturas absolutas. Sabiendo que cuando se enfría un gas de 0° a -1°C pierde 1/273 de su presión, Kelvin dedujo que a -273°C el gas no debería tener presión ninguna, y llamó a -273°C el cero absoluto. Las barras más claras representan las temperaturas corrientes que se indican abajo en grados Fahrenheit y centígrados.
Contando calorías para medir el calor
Al perfeccionarse los termómetros a fines del siglo XVIII, los científicos se dedicaron a experimentos sobre la naturaleza del calor.
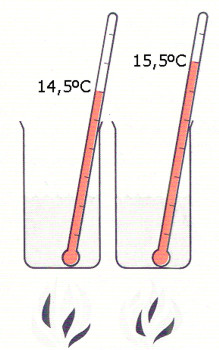
| MEDIDA PARA LOS QUE VIGILAN SU PESO. La unidad actual de medida del calor, la caloría, es la cantidad de calor que eleva la temperatura de un gramo de agua un grado, (concretamente, de 14,5 °C a 15,5 °C, según se ilustra al lado). «La gran caloría», conocida de todos los que vigilan su peso, es mil veces mayor que aquélla y proporciona al cuerpo el calor para elevar 1.000 gramos de agua 1° C. |
El escocés Joseph Black hizo observar que la temperatura era una medida de la intensidad del calor, pero no de la cantidad total de calor contenida en un objeto. Los científicos llegaron a la conclusión de que el calor era un fluido sin peso, llamado calórico, que entraba y salía de los cuerpos materiales sin ser visto. Incluso el gran químico francés Antoine Lavoisier pensaba que cuando un cuerpo se calentaba se llenaba de calórico. Lavoisier tomó como unidad de medida del calor la cantidad de calor necesaria para elevar un grado la temperatura de una unidad de agua, lo que fue el antecesor de la caloría actual.
| UN CONDE Y SUS CACHARROS DE COCINA. Esta caricatura, publicada en 1800, muestra al Conde Rumford calentándose delante de una estufa Rumford, sobre la cual se ven dos potes de cocina diseñados por él. Rumford, que era tory, tuvo que salir de América durante la Revolución, pero le fue bien en Europa y llegó a ser un conde bávaro. Tomó su nombre de la ciudad de Rumford, en Nueva Hampshire |
La teoría del calórico, que satisfacía a la mayoría de los científicos, fue negada por el notable Conde Rumford, nacido Benjamín Thompson, de Woburn, Massachusetts. El Conde Rumford mantuvo una idea anterior, la de que el calor procedía de un movimiento interno de las sustancias (que ahora se sabe es el movimiento de las moléculas o los átomos). Por medio de un famoso experimento con una máquina para taladrar cañones, demostró que el calor no puede ser una sustancia material puesto que podía producirse en cantidades ilimitadas exclusivamente por fricción. Pasaron 50 años antes de que la evidencia presentada por Rumford fuese aceptada por completo.
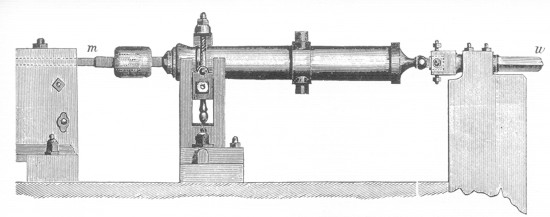
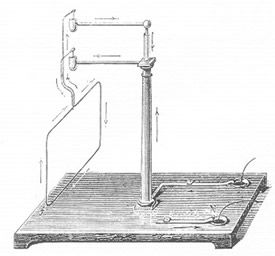
UNA FÁBRICA DE CALOR. En 1798, en una fábrica de municiones de Munich, el Conde Rumford montó el aparato reproducido en el grabado de más arriba; se encaja apretadamente una varilla taladradora de acero (m) a un grueso cilindro, el cual a su vez se une a un cañón giratorio (n). El cilindro rotatorio está provisto de una camisa llena de agua. El calor de fricción hacía hervir el agua, y como seguía hirviendo en tanto que el cilindro giraba, Rumford mantuvo que la fuente de calor era inagotable y que el calor no era una sustancia almacenada en el cilindro.
El vapor y los caballos de fuerza
Hoy en día los caballos de fuerza es algo que asociamos a los automóviles muy veloces, pero esa expresión fue ideada a fines de los años 1700 por el inventor escocés James Watt para medir la fuerza de sus nuevas máquinas de vapor.
Calculó cuántas libras podía levantar un caballo desde el suelo a la altura de un pie, en un minuto, inventando así la unidad que llamó caballo de fuerza. Watt no inventó la máquina de vapor; cuando todavía era niño, se encontraba ya bastante extendido el uso de una máquina de vapor, la Newcomers, que era a. su vez un adelanto sobre dos anteriores, las máquinas de Savery y de Papin, las cuales eran ensayos muy primitivos de la utilización del vapor.

RETRATO PRE-REVOLUCIONARIO. Este retrato del pintor francés Jacques Louis David nos muestra a Antoine Lavoisier y a su mujer en su laboratorio. Si bien Lavoisier mantenía ciertas reservas sobre la teoría del calórico, fue él quien con tres colegas más llamó «calorique» al calor. Lavoisier murió en la Revolución Francesa; su mujer conservó su nombre, después de casarse con el Conde Rumford
Newcomen había combinado las mejores características de aquellas máquinas, pero el aparato era tan poco eficaz que se necesitaba una mina de hierro para fabricarlo, y una mina de carbón para hacerlo funcionar.

RETRATO DE UNA LEYENDA. En el cuadro del siglo XVIII, a la izquierda, el joven James Watt contempla el vapor que sale de la tetera de su madre. La leyenda familiar de que Watt concibió la idea de la máquina de vapor en sus reflexiones a la hora del té, fue iniciada años más tarde por una tía suya.
El interés de Watt por la fuerza del vapor se despertó cuando le pidieron que reparase una máquina de Newcomen; la reparó y se dedicó luego a diseñarla de nuevo, inventando casi todos los perfeccionamientos posibles. Watt consiguió que su máquina de vapor hiciese girar una rueda, y su nuevo modelo, uno de los cuales se muestra más abajo, hizo que la máquina de vapor fuese por vez primera práctica y eficiente. En 1774 se asoció con un hombre de negocios inglés, y en una fábrica cerca de Birmingham, Inglaterra, construyó máquinas de vapor hasta su retiro en 1800.

DISEÑO PARA UNA NUEVA ERA. La máquina de vapor fue utilizada en 1788 en la factoría de Watt. Contiene la mayor parte de sus inventos, tales como el regulador de admisión de vapor, y una disposición de brozas y engranajes para convertir los movimientos rectilíneos en giratorios.
Estas máquinas hicieron del vapor una fuente universal de fuerza. Si bien las máquinas de vapor han sido muy perfeccionadas, sus principios fundamentales han permanecido inalterados.
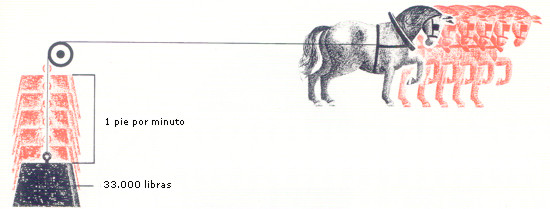
COMO MEDIR UN CABALLO. El inventor de la máquina de vapor, Thomas Savery, había observado que su máquina podía hacer el trabajo de dos caballos, pero fue James Watt quien estableció el caballo de vapor como unidad de medida. Determinó que un caballo que tirase un minuto podía levantar unas 32.400 libras a la altura de un pie. Más tarde, y para facilitar el cálculo de la fuerza de sus máquinas fijó le unidad en 33.000 libras elevadas un pie por minuto. En el lenguaje científico esto se expresa 550 pies-libras por segundo, o 75 kilográmetros por segundo.

LA FUERZA DE LA CORRIENTE. La fuerza eléctrica se mide ahora en voltios en honor de Alessandro Volta, quien a veces juzgaba una batería por el relámpago que veía cuando se tocaba los párpados con los alambres. El voltaje es la medida de la presión eléctrica con que la corriente fluye por un alambre. Este potencial es semejante al del agua almacenada en un tanque elevado. Cuanto más descienda el agua, tanto mayor será la presión con que saldrá. Asimismo, cuanto mayor sea el voltaje de una batería, mayor será la fuerza de la corriente.
| A ELECTRICIDAD APILADA. La batería de Volta (derecha), llamado pila voltaica, consistía en dos grupos de discos aparejados y superpuestos, de cinc y plata, colocados entre cartón empapado en agua salada. Al conectar las columnas, fluía entre ellos una corriente producida por reacción química. |
EL OHMIO: Regla de resistencia
UNA BATERÍA DE BOTELLAS. Lo fuente de electricidad de Ohm no era en realidad una botería, sino un conjunto de botellas de Leyden unidas por varillas de latón (arriba). Lo botella de Leyden era una vasija revestida de hoja de estaño que podía almacenar una gran cantidad de electricidad estático |
|

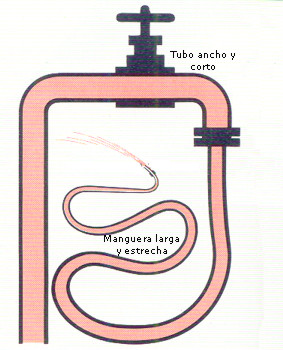
COMO ENTORPECER LA CORRIENTE. George Simon Ohm, maestro de escuela alemán, demostró que la corriente dependía de la resistencia del circuito de alambre o través del cual fluye, de lo misma manera que el agua fluye con más facilidad por un tubo ancho y corto que por una larga y estrecha manguera de jardín. Pasó luego a formular la Ley de Ohm; que la corriente varía en proporción directa a la fuerza de la batería y en razón inversa a la resistencia de los alambres. Cuando las teorías de Ohm se publicaron en 1826 fueron objeto de burla.
EL AMPERIO: Medida de la corriente
| UNA CORRIENTE QUE SIRVE DE BRÚJULA. La brújula eléctrica aquí representada fue ideada por Ampère durante sus estudios sobre el magnetismo producido por la electricidad. Cuando una corriente pasa a través del rectángulo de alambre, éste resulta magnetizado y actúa igual que la aguja de una brújula. |

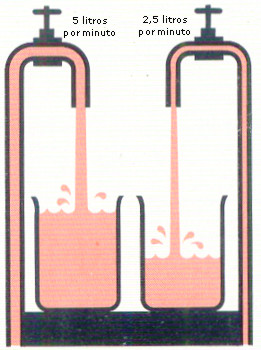
LA CORRIENTE QUE FLUYE. André Marie Ampère, llamado el Newton de la electricidad, fue el primero en describir la corriente como el flujo de electricidad a lo largo de un alambre. Este flujo es semejante al movimiento del agua a través de un tubo (arriba, derecha). El diagrama muestra dos tubos, uno de un ancho doble del otro; en un tiempo determinado, del tubo más ancho sale el doble de agua. Así como la velocidad del flujo del agua se mide en litros por segundo, la corriente se mide en culombios por segundo. Un culombio por segundo se llama un amperio.
Piedras angulares de las medidas eléctricas
La electricidad estática que hace que los jerséis de lana crepiten y suelten chispas, era ya bien conocida en el siglo XVIII, pero en 1791 la idea que el hombre tenía de la electricidad empezó de pronto a modificarse: Alessandro Volta, profesor de Física italiano, se puso sobre la lengua una cuchara de plata y un poco de papel de estaño, y al conectar los dos metales con un alambre de cobre notó un gusto ácido en la boca. Esto le dio la idea de su "pila voltaica", la primera batería del hombre.
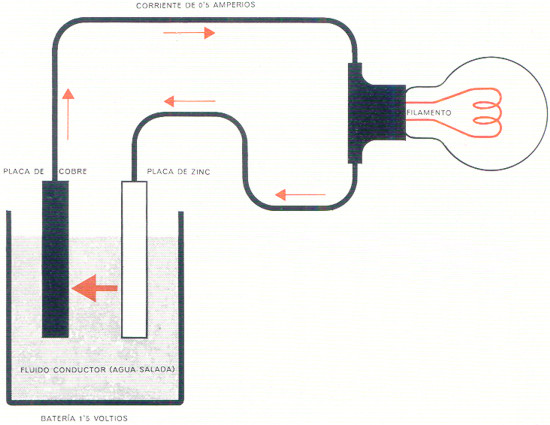
LA LEY DE OHM EN ACCIÓN. En el sencillo circuito eléctrico representado aquí, una corriente de 0,5 amperios aparece (flechas) fluyendo del polo positivo el negativo de una batería de 1,5 voltios, a través de un circuito que presenta 3 ohmios de resistencia. Estos valores están de acuerdo con la ley de Ohm, según la cual corriente = voltaje / resistencia. Cuando una corriente pasa a través del filamento de una bombilla, aquél se calienta hasta incandescer. La potencia de bombilla se expresa en vatios (voltios x amperios).
André Marie Ampère, matemático francés, investigó la naturaleza magnética de la electricidad en movimiento e ideó la palabra "galvanómetro". Poco tiempo después, George Ohm utilizó un galvanómetro para demostrar que un flujo de corriente es afectado por el alambre a través del cual pasa. En honor de todos ellos la "presión" de una corriente se mide en voltios, su velocidad de flujo en amperios y la resistencia del conductor en ohmios.
Una herradura que electrificó el mundo
Unos 30 años después de haber inventado Volta la batería, dos publicaciones científicas anunciaron una nueva fuente de corriente eléctrica; en Inglaterra, Michael Faraday anunció en 1832 que había conseguido "convertir magnetismo en electricidad": había hecho pasar una corriente a través de una espiral de alambres, creando un campo magnético que inducía una corriente momentánea en una segunda espiral.

UN IMÁN QUE HIZO HISTORIA. Con este extraño electroimán de la derecha, Joseph Henry hizo historia en el terreno científico. Al pasar la corriente de una batería por las bobinas enrolladas en uno borra de hierro en forma de herradura, de 24 cm de altura, el hierro se imantó. La barra del primer plano estaba unida a la herradura y envuelta en una segunda serie de bobinas (no visible) que transmitía una corriente inducida.
En América, Joseph Henry afirmaba haber hecho casi lo mismo utilizando el imán representado en la página de enfrente. En realidad el trabajo de Henry precedió al de Faraday, pero no quiso que se le acreditase el descubrimiento. Este hallazgo transcendental, con el tiempo proporcionó una fuente de corriente que se usa en los generadores, dínamos y motores.
Mientras Faraday fue aclamado, Henry fue relegado al olvido durante mucho tiempo. Pero hoy en día el henrio, así como el faradio, es una unidad eléctrica.
| UN INGLÉS FAMOSO |
UN AMERICANO OLVIDADO |
|
Capítulo 3
La actividad de las moléculas en movimiento
UN PUÑADO DE CALOR. Esta fotografía poco corriente muestra cómo el aire calentado por una mano humana se eleva de entre los dedos, muy a semejanza de como las «olas de calor», vibran sobre las carreteras en días muy calurosos. Si bien el calor es una forma invisible de energía radiante, su efecto sobre el aire ha sido captado por fotografía Schlieren, con exposiciones rapidísimas.
Cierto día, dentro de miles de millones de años, nuestro brillante mundo se desvanecerá en unas tinieblas grises y silenciosas. No será la caída de la noche, sino la muerte del universo, pues la inevitable extinción de la luz y de todas las características familiares del cosmos es una deducción lógica del nuevo concepto del calor, que surgió al principio del siglo XIX en sustitución de la desacreditada teoría del calórico.
El trabajo de hombres como Rumford, Davy y Joule había demostrado que el calor era consecuencia del movimiento: un taladro que perfora el ánima de un cañón; el frote mutuo de dos pedazos de hielo; una paleta que gira en un cubo de agua, todo ello engendraba calor.
PIEDRAS ANGULARES DE LOS EDIFICIOS QUÍMICOS |
Pero por cada uno de estos movimientos que producen calor, existe también un ejemplo de algo que emite calor sin moverse: una tetera llena de agua puede estar caliente; también pueden estarlo las ruedas de un automóvil que acaba de detenerse; incluso el asiento de los pantalones de un niño quizás esté caliente al final del recorrido por un tobogán de un campo de juegos.
Podría argumentarle que tal calor en objetos inmóviles no era sino calor almacenado durante algún movimiento que había cesado algunos minutos antes. Pero ¿qué acción existe en el agua que se calienta sobre una estufa?
Y si el calor ha sido almacenado en un neumático o en los pantalones de un niño, ¿en qué forma se ha acumulado si el calórico no existe? La respuesta a estas dos preguntas se basa en un solo hecho: un objeto inmóvil no está realmente inmóvil. Es, en realidad, una masa de invisibles pedacitos de materia, átomos y moléculas que vibran o se mueven a velocidades increíbles. El calor de cualquier sustancia es una manifestación de ese frenesí constante. En objetos fríos los movimientos moleculares son relativamente lentos; en objetos más calientes, son más rápidos.
La idea de que nuestro sólido mundo no es tan sólido como parece, es muy antigua; es muy posible que la teoría atómica sea la hipótesis científica más antigua todavía aceptable hoy. Ya en el siglo V a. J., el filósofo griego Demócrito había tenido la idea de que el universo consistía en una aglomeración de innumerables bolas infinitesimales que llamó atomoi. Los griegos nunca comprobaron experimentalmente esa idea, pero las pruebas científicas aportadas han demostrado que estaba bien orientada.
Como es lógico, los científicos modernos han modificado aquella intuición de los griegos hasta dejarla casi irreconocible. Entre otras cosas, han descubierto que el átomo es quizá la entidad más sociable del universo, pues casi siempre se le encuentra combinado con otro átomo o grupo de átomos; tales combinaciones atómicas se llaman moléculas; así, por ejemplo, el átomo de oxígeno está generalmente unido a otro átomo de oxígeno formando la molécula de oxígeno. Es más, el oxígeno consistente en átomos sencillos de oxígeno, es una curiosidad científica y, además, un veneno peligroso. El oxígeno puede también combinarse con el carbono, formando una molécula de óxido de carbono, el peligroso gas de los escapes de los automóviles. O unirse con dos átomos de hidrógeno, formando agua H2O.
MOLÉCULAS GASEOSAS; PESOS DIFERENTES, PERO NÚMEROS IGUALES
|
Una molécula corriente es tan pequeña, que para describir su diámetro en centímetros sería necesario alejarse siete ceros de la coma decimal; se necesitarían doscientos cincuenta millones de moléculas de hidrógeno en fila para hacer una pulgada. Y en condiciones ordinarias un centímetro cúbico de gas contiene unos 30 quintillones de moléculas. Este número es tan grande que si todos los hombres, mujeres y niños de la tierra contasen una molécula por segundo, tardarían unos 30 años en llegar al final. Y si ese número parece inmenso, considérese que se necesitan más de 1000 veces más de moléculas de hidrógeno para el peso de un gramo.
Es obvio que la molécula solamente puede evidenciarse por la fuerza de los números. Y, no obstante, el primer estudio sobre el comportamiento molecular, publicado en 1738, se basaba en el posible comportamiento de moléculas individuales. El autor de aquel trabajo fue Daniel Bernoulli, descendiente de una de las familias famosas de la ciencia. Los Bernoulli, junto con otras familias como los Darwin y los Curie, fueron para la ciencia lo que los Bach para la música, cuatro generaciones de Bernoulli contribuyeron con brillantes trabajos a la medicina, física y matemáticas.
Colisión, bote y rebote
No obstante, pocos de sus contemporáneos tomaron en serio las ideas de Daniel Bernoulli, y nadie vio en ellas el anticipo de ideas modernas, como era el caso. En efecto, Bernoulli pidió a sus colegas científicos que se imaginasen un espacio limitado, pero completamente vacío, en el cual hay solamente una molécula. Esta molécula solitaria se mueve a través del vacío a gran velocidad y rebotando una y otra vez dentro de su encierro. A consecuencia de ese eterno movimiento, Bernoulli se imaginó a cada una de las paredes como recibiendo impactos aislados sucesivos.
Si bien el impacto de una molécula es despreciable, el golpeteo combinado de trillones y trillones de tales moléculas en un recipiente ocasiona una presión contra sus paredes. Es evidente que si se reduce el espacio del recipiente, las moléculas tendrán menos espacio para moverse, y chocarán más a menudo contra las paredes, aumentando así la presión. Esta relación entre presión y volumen había sido ya descubierta en el siglo XVII por el famoso científico inglés Robert Boyle. Miembro de aquel trust de cerebros de los reyes y consejeros de la Restauración llamado Colegio Invisible, del cual salió la Real Sociedad de Londres para Fomentar el Conocimiento Natural, Boyle había montado uno de los laboratorios mejor equipados de Europa, y lo utilizó para diversidad de investigaciones.
Con la ayuda de Robert Hooke, Boyle construyó la primera bomba de aire eficiente y demostró que, aplicando presión al aire, el más común de los gases, se reduce su volumen en una relación matemática sencilla: cuando a temperatura constante se dobla la presión, el aire se comprime a la mitad de su volumen normal. Considerando de otra manera el resultado de Boyle, podría también decirse que si se comprime el aire a la mitad de su volumen normal la presión de sus moléculas se duplica. Bernoulli calculó matemáticamente la presión que podían crear unas moléculas de gas que se moviesen rápidamente, y esas presiones corresponden casi exactamente con lo que había observado Boyle.
Bernoulli también indagó la cuestión de la influencia de la temperatura sobre los gases, y demostró matemáticamente lo que Charles y Gay-Lussac observaron décadas más tarde: que el aumento de temperatura hace que el gas se dilate en una proporción matemática definida, si se dobla la temperatura absoluta de un gas a presión constante, el volumen del gas se duplica. También observó que, al calentar un gas en un recipiente cerrado, la presión en el recipiente aumenta.
El hecho de que los neumáticos de un automóvil necesitan ser menos hinchados en verano que en invierno, es un ejemplo de este principio, ya que en tiempo caluroso el aire en el neumático se calienta y se dilata, por lo cual se necesita menos aire para mantener la presión al nivel requerido. Eso también explica por qué las «bombas» de aerosoles no deben ser arrojadas al fuego; el calor hará que incluso la pequeña cantidad de aerosol que queda en el recipiente se dilate y lo haga estallar.
Bernoulli calculó que los efectos de la temperatura sobre el volumen y la presión de un gas pueden ser fácilmente explicados suponiendo que el calor hace que las moléculas del gas se aceleren. Cada una de las moléculas chocará más con las paredes del recipiente, aumentando la presión.
En realidad, el trabajo de Bernoulli estaba un siglo adelantado respecto a su tiempo; sus teorías llegaron en un momento en que el calórico era la explicación más popular del calor, y nadie le escuchó cuando, en su trabajo largo tiempo olvidado, Hydrodynamica, hizo caso omiso del calórico diciendo que «se puede considerar el calor como el aumento del movimiento interno de las partículas». En efecto, el postulado de Bernoulli fue formulado más de 100 años antes del pronunciamiento final de Joule sobre la equivalencia del calor y del movimiento.
El prodigio a quien llamaron «El chiflado»
El trabajo de Bernoulli captó la imaginación de uno de los más brillantes científicos del siglo XIX: James Clerk Maxwell. A semejanza de muchos otros hombres de aquella época, Maxwell fue un «niño prodigio». Nació en Edimburgo en 1831 y muy pronto mostró gran interés por el mundo físico que le rodeaba.
AUMENTO DE LA PRESIÓN DEL GAS POR AUMENTO DE TEMPERATURA |
En la escuela se consideraba a Maxwell como estudiante bien dotado, y consiguió sobresalir en matemáticas, inglés y latín, pero los demás muchachos le llamaban «El chiflado» por los trajes algo afectados que su padre le escogía. No obstante, a los 17 años había ya impresionado tanto a sus profesores que en la Royal Society de Edimburgo se leyeron dos de sus trabajos. Los leyeron sus profesores, porque «no se consideraba adecuado que un muchacho de su edad subiese a la tribuna».
Después de haberse graduado en Cambridge, Maxwell ganó un premio en la Universidad con un ensayo sobre la naturaleza de los anillos de Saturno; en él criticaba varias hipótesis de la época que afirmaban que los anillos eran o bien sólidos, fluidos o parcialmente «aeriformes», antigua palabra que quería decir gaseosos. Utilizando las matemáticas en su apoyo, Maxwell mantuvo que los anillos no podían ser sólidos, pues la atracción de la gravedad del planeta haría que se desintegrasen. Razonó también que si fuesen fluidos las ondas creadas por su movimiento los destrozarían. Su idea de que los anillos estaban formados por partículas desconectadas fue más tarde confirmada por las observaciones astronómicas.
Cálculo del trayecto de una colisión
El examen de lo que él llamó «vuelo de tejuelas» le condujo a estudiar el comportamiento de grupos de partículas de gas en colisión, y afirmó que «sus pequeñas partículas están en rápido movimiento, aumentando la velocidad con la temperatura, de modo que la naturaleza exacta de este movimiento se convierte en otro objeto de la curiosidad racional». Extendió los cálculos de Bernoulli teniendo en cuenta las colisiones de las moléculas del gas entre sí, y admitiendo que probablemente todas las moléculas se mueven a diferentes velocidades y cómo obtener las relaciones correctas de presión, densidad y temperatura. «No es necesario, escribió Maxwell, suponer que cada una de las partículas se desplaza grandes distancias en la misma línea recta, pues el efecto, en cuanto a producir presión, será el mismo si las partículas chocan entre sí, de modo que la línea recta descrita puede ser muy pequeña.»
Estas líneas rectas y cortas entre colisiones fueron descritas por su contemporáneo alemán Rudolf Clausius, como «trayectoria libre media», expresión que aún se usa, y que significa que en condiciones estándar de temperatura y presión, cada una de las moléculas tendrá por término medio una trayectoria de longitud determinada: así, por ejemplo, el hidrógeno tiene una trayectoria media entre colisiones de 0,0000016 centímetros. Esta distancia parece realmente muy corta, pero el diámetro de una molécula aislada es tan pequeño, que relativamente es grande. Si aumentase su tamaño hasta llegar a ser el de una pelota de tenis, la trayectoria libre media entre colisiones, así aumentada, sería algo superior a la longitud de la pista de tenis, quedando espacio sobrado para que la molécula «pelota de tenis» se pudiera mover a velocidad vertiginosa antes de chocar con una de sus compañeras. En este momento existen quintillones de moléculas chocando entre sí a razón de 15 mil millones de colisiones por segundo. Así ocurre que un gas se dilata cuando se suprime el recipiente. Las moléculas continúan moviéndose hasta ser desviadas por colisiones con otras moléculas o con otras paredes.
Cuando el gas está encerrado en un recipiente inmóvil, el movimiento en una dirección está compensado por un movimiento molecular igual en la dirección opuesta. Por otra parte, cuando el gas comienza a fluir, por ejemplo, el aire en forma de viento que sopla a través de un campo, o el gas natural que se mueve a lo largo de una tubería, la velocidad del movimiento de avance del conjunto de la masa gaseosa no es sino un desplazamiento superpuesto a la velocidad muy superior con que las moléculas aisladas se mueven sin rumbo fijo dentro de la masa circulante de gas. Las moléculas de tales nubes gaseosas no ejercen efectos mutuos apreciables excepto durante las colisiones.
250 millonésimos de centímetro
Entre las moléculas actúan dos clases de fuerzas eléctricas: una fuerza de atracción, la cual, como la gravedad, actúa a distancia limitada (unas cuantas veces el diámetro de la molécula), y una poderosa fuerza repelente que actúa a distancia mucho menor. En el estado sólido, las fuerzas entre las moléculas determinan la estructura. A un punto intermedio (a unas 250 millonésimas de centímetro del centro de la molécula) estas dos fuerzas se compensan. Solamente en este punto hipotético de fuerza cero sería posible que una molécula permaneciese en reposo, al estar en equilibrio las fuerzas que sobre ella actúan. Si una segunda molécula se acercase algo más, la fuerza repelente la alejaría; si se alejase un poco, la fuerza de atracción la haría volver. Las dos fuerzas opuestas establecen el punto de equilibrio y determinan que las moléculas vibren levemente, acercándose y apartándose, como mantenidas por muelles invisibles.
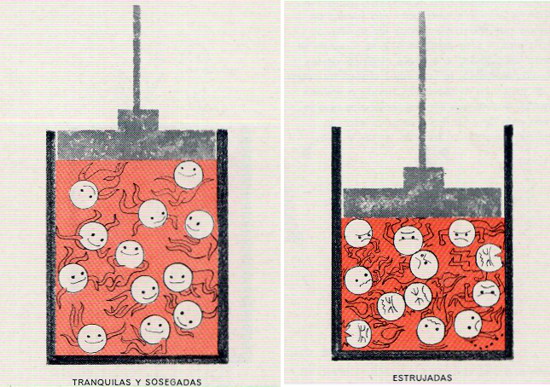
CUANDO FALTA SITIO. ¿Qué sucede con lo presión de un gas a temperatura constante si se reduce su volumen? Robert Boyle descubrió que si el volumen de un gas se reduce a lo mitad, la presión se dobla. Las moléculas siguen moviéndose a la misma velocidad, pero tienen la mitad del espacio y empujan el doble contra las paredes.
Una pequeña barra de hierro aparece maciza e inmóvil, pero los átomos componentes del hierro están completamente separados, suspendidos en el espacio. Individualmente cada uno de los átomos está vibrando, acercándose y alejándose de cada uno de sus vecinos. Colgados en el espacio, los átomos forman las intersecciones de un enrejado de celosía. En el hierro, el enrejado se compone de pequeños cubos con un átomo en cada esquina y uno en el centro. Otras sustancias presentan enrejados con lados que forman triángulos, paralelogramos, hexágonos y otras formas. Estos diferentes enrejados proporcionan a cada elemento su estructura interna característica. Cuando se rompe un objeto, se separa siguiendo las líneas del enrejado.

ROTURA DE LA TENSIÓN. Mostramos aquí que un líquido se evaporó cuando algunas moléculas, moviéndose con suficiente velocidad y en la dirección apropiada, superan la tensión superficial, la fuerza de atracción que mantiene juntos las moléculas superficiales, y se escapan al aire. Cuando se calienta un líquido, la energía cinética de las moléculas aumenta, lo cual hoce que se muevan más de prisa. La evaporación tiende a enfriar el líquido, puesto que son las moléculas que se mueven más de prisa las que atraviesan la superficie, dejando a las más lentas y frías.
Un aumento de temperatura acelera la velocidad media de vibración molecular en los sólidos, lo mismo que en los gases. Cada movimiento oscilatorio de una sola molécula bajo la influencia del calor, es más amplio y más rápido y aumenta la separación molecular media. En otras palabras, un objeto sólido se dilata como un todo cuando se aumenta la temperatura. A medida que el calor que se añade obliga a que el movimiento de las apretadas moléculas se haga cada vez más turbulento, se llega a un momento en que algunas de las moléculas comienzan a desligarse de las fuerzas de unión ejercidas por sus compañeras, se salen del enrejado regular. Al seguir aumentando el calor, más y más moléculas se liberan de su cautiverio. En cuanto el rígido orden comienza a fallar, agregados enteros de moléculas comienzan a deslizarse, unos junto a otros. La sustancia no es ya un sólido, y la relajación del orden recibe el nombre de fusión.
Cuando se ha alcanzado una fluidez interna total, se dice que las moléculas están en estado líquido. Si un hombre pudiese hacerse lo suficientemente pequeño para observar esa estructura interna, se daría cuenta de que las moléculas de los líquidos tienen un movimiento más enérgico que las de los sólidos. En los líquidos las moléculas entran y salen de sus respectivas zonas de influencia. Así es que la fuerza de una molécula sobre otra solamente puede ejercerse brevísimo tiempo. Los vecinos aparecen y desaparecen en millonésimas de segundo. Las colisiones ocurren con frecuencia casi increíble. En los líquidos, lo mismo que en los sólidos, al añadir calor se aumenta la distancia media entre los centros moleculares. Por lo tanto, lo mismo que para los sólidos, la teoría cinética explica por qué los líquidos generalmente se dilatan al añadirles calor.
Rotura de la barrera de superficie
La superficie molecular de un líquido actúa como una especie de barrera del mundo externo. Por ejemplo, una molécula situada bajo la superficie, y que se mueva hacia arriba a gran velocidad, puede salirse del líquido penetrando en la atmósfera. Este efecto es la evaporación. Pero la molécula tiene que actuar contra la superficie así como contra la presión de las moléculas de aire para poder pasar. Solamente cuando la temperatura es lo suficientemente elevada, permite la energía media del líquido un escape apreciable de moléculas a la atmósfera.
Al añadir calor, las moléculas más rápidas se escapan, saliendo a través de la superficie. Transfieren a la atmósfera parte de su energía cinética en forma de calor, siendo esta la razón por la cual la evaporación es un proceso de enfriamiento. A medida que se va continuando la adición de calor al líquido, más y más moléculas alcanzan velocidades que les permiten escaparse a través de la superficie. Cuando un número suficiente de las moléculas alcanza tal punto, se produce un burbujeo y el líquido alcanza la ebullición.
En el punto de ebullición toda adición de energía en forma de calor se reparte entre las moléculas que han quedado en el líquido, y eventualmente también su velocidad aumenta lo suficiente para que puedan escaparse. En otras palabras, cuando se calienta regularmente un líquido, su temperatura aumenta hasta un cierto punto, al llegar al cual la temperatura permanece constante, mientras el líquido se va evaporando. La teoría cinética explica este proceso como un aumento de la velocidad de cada una de las moléculas hasta el punto en que su energía cinética es suficiente para escapar de la atracción de las moléculas vecinas.
Al llegar a aquel punto se produce un cambio de estado, el líquido se convierte en gas. El calor que se emplea en el proceso del cambio de estado es el «calor latente» de Joseph Black, discutido en el capítulo 2. El «calor específico» de Black puede también ser explicado en términos de los movimientos de las moléculas. Cualquier calor que «se introduce» en una sustancia es una manifestación del movimiento de sus partículas.
Se presenta ahora una pregunta: ¿De cuántas maneras pueden moverse esas partículas componentes? La respuesta es que depende de su forma. Si son bolas, pueden sencillamente moverse de tres maneras, como una pelota en una pista de tenis, que puede moverse hacia arriba, hacia abajo o lateralmente. Pero supongamos que las partículas tienen la forma de una pesa de gimnasia, como ocurre con muchas moléculas. Si arrojamos una pesa de gimnasia sobre una pista de tenis, es evidente que puede moverse hacia arriba, hacia abajo o de lado, como una pelota de tenis, pero también puede dar vueltas sobre sus extremos. Cada tipo de movimiento puede absorber cierta energía calorífica; así pues, una molécula en forma de pesa de gimnasia, debido a su movimiento giratorio, puede absorber un poco más de calor que una en forma de bola, que no gira, pero esa adición de calor no afecta al termómetro. Como es natural, la cuestión se complica si la molécula consiste en tres bolas unidas entre sí, como la molécula de agua, la cual tendría todos los movimientos de una bola, más los de una pesa de gimnasia, más toda una serie de giros complicados y fantásticos que dependen de su forma en tres partes. Puesto que cada uno de aquellos movimientos individualmente absorbería una cantidad igual de calor, su capacidad calorífica sería mayor que la de una molécula en forma de pesa. Las diferencias en el movimiento, que son consecuencia de las diferencias de estructura molecular, son, por lo tanto, un factor en las diferencias de calor específico. Hay, además, otro factor: los calores específicos se basan en pesos iguales de sustancias, pero como el número de moléculas varía en diferentes sustancias, aun siendo los pesos iguales, el número de moléculas disponibles para absorber calor no es el mismo.
La fuerza motriz del calor
Nicolás Sadi Carnot, hijo de un general francés revolucionario, hizo un estudio del calor y del movimiento desde un punto de vista práctico. Carnot publicó en 1824 un trabajo titulado «Reflexiones sobre la fuerza motriz del calor». Si bien despertó poco interés y fue aparentemente olvidado, fue resucitado 25 años después, reconociéndosele su idea creadora.
En la introducción a su trabajo, Carnot hizo notar que las trepidantes máquinas de vapor de su tiempo se habían hecho de importancia vital para la industrialización del mundo, entonces en rápido desarrollo. Hizo observar que su eficiencia había mejorado gracias a diversas modificaciones de diseño, y se propuso determinar hasta dónde podía continuar tal mejora.
«Con frecuencia ha sido planteada la pregunta, dijo, de si la fuerza motriz del calor es ilimitada, de si los posibles perfeccionamientos de las máquinas de vapor tienen... un límite que la naturaleza de las cosas no permitirá que sea superado por medio alguno, o bien si, por el contrario, esos perfeccionamientos pueden ser llevados a cabo indefinidamente.»
Al enfrentarse con este problema, Carnot consideró cuidadosamente las máquinas de vapor, preguntándose qué es lo que en realidad ocurre en ellas. Observó que su funcionamiento es un proceso cíclico que empieza por adicionar calor al agua, convirtiéndola en vapor. El vapor se expansiona en el cilindro y realiza un trabajo mecánico empujando el pistón. Luego pasa a un condensador frío, donde se convierte nuevamente en agua y vuelve a la caldera.
Razonando que las máquinas de vapor existentes eran ineficaces principalmente por las pérdidas de vapor y la fricción del pistón, Carnot imaginó una máquina de vapor ideal sin defectos térmicos ni mecánicos. La concibió sencillamente como un cilindro provisto de un pistón sin pérdidas ni fricción, con la cabeza del pistón y las paredes laterales del cilindro perfectamente aisladas. El calor necesario para producir el vapor pasaba libremente a través del fondo del cilindro.
COMO REDUCIR EL CONSUMO. Un termostato utiliza el hecho de que diferentes sustancias tienen diferentes coeficientes de expansión, es decir, se dilatan y contraen en proporción diferente durante las variaciones de temperatura. Cada termostato lleva una barra formada por dos metales diferentes. El metal inmediato al contacto eléctrico es el de coeficiente más elevado, de modo que cuando el calor sobrepasa cierto punto se dilata y dobla la barra alejándolo del contacto y apagando el horno (A). Si la temperatura desciende la barra vuelve a doblarse hasta el contacto (B).
Así pues, un ciclo completo de esta máquina ideal consiste en calentar el agua hasta formar vapor, dejar que el pistón se eleve bajo la presión del vapor y que el pistón vuelva a su posición primitiva al convertirse el vapor en su forma original de agua. En el curso del estudio del ciclo refrigerante, Carnot finalmente se dio cuenta de que cierta pérdida de calor era necesaria para el funcionamiento de cualquier máquina de vapor.

UN HOMBRE DE IDEAS CALIENTES. Hijo del ministro de Defensa de Napoleón, Sadi Carnot estaba más interesado en idear una máquina de vapor mejor, que en mejorar la eficiencia de los ejércitos. Investigando la base teórica de aquellas máquinas, realizó una importante observación: el calor solamente realiza trabajo cuando fluye de un lugar caliente a otro más frío. A esto se llama el Principio de Carnot. Este ingeniero francés determinó también que cuanto mayor es la diferencia de temperatura tanto más trabajo realiza el calor.
Una vez que el vapor había elevado el pistón, sería imposible hacerlo volver a bajar sin sacar el vapor de la cámara del pistón y condensarlo. En esta condensación, que es esencialmente un proceso de refrigeración, debe necesariamente perderse algún calor.
Hay que bajar para poder trabajar
En verdad eso era un principio fundamental de las máquinas de vapor: no todo el calor recibido puede ser convertido en trabajo mecánico, porque parte se pierde en la condensación del vapor. Carnot había descubierto que el calor debe moverse «hacia abajo», es decir, pasar de temperaturas altas a bajas, para realizar trabajo. Por cierto que, durante la mayor parte de su vida, Carnot creyó en el calórico, al que imaginaba como un fluido que se movía a través de su máquina y funcionando de la misma manera que el agua hace girar la rueda de un molino.
El descubrimiento de Carnot de que el calor tiene que moverse en una dirección definida sugiere una de las leyes fundamentales de la física: la Segunda Ley de Termodinámica. Esta ley fue formulada por vez primera por el físico alemán Rudolf Clausius, quien manifestó: «Una máquina que actúe por sí misma no puede, sin la ayuda de un agente externo, hacer pasar calor de un cuerpo a otro a temperatura superior». Lord Kelvin expresó la misma ley en términos algo diferentes: «No es posible obtener efectos mecánicos de una porción de materia por medio de agentes inanimados, enfriándola a temperatura inferior a la del más frío de los objetos que la rodean». En esencia, la ley es ésta: El calor no pasa, por sí mismo, de un lugar frío a uno caliente.
Si uno se detiene a pensar en la Segunda Ley, resulta que es un hecho de la vida cotidiana. Por ejemplo, imaginemos un tostador de pan sobre una mesa de cocina ordinaria, donde la temperatura del aire es de 18 °C. Si todo el calor de la habitación «pasase» al tostador, éste se pondría incandescente. Sin embargo, eso no sucede nunca; el tostador solamente se calienta si se conecta a un enchufe eléctrico, con el consiguiente consumo de energía eléctrica. Por otra parte, ese mismo tostador caliente se enfriará inmediatamente al desenchufarlo, sin el menor consumo de energía.
Este flujo de calor en un solo sentido, expresado por la Segunda Ley, lleva consigo la sentencia de muerte del universo. Insistiendo en la analogía entre el calor y el agua, podemos decir que el calor, como el agua, tiene que fluir hacia abajo para efectuar trabajo. Sin colinas no habría energía hidráulica, y de la misma manera, sin colinas de temperatura (es decir, lugares más calientes que otros) el calor no puede producir trabajo. Así como sobre la tierra se produce una erosión que tiende a nivelar las montañas, así hay también en el universo un proceso de erosión calorífica que tiende a nivelar la temperatura. Ese insidioso nivelador es la pérdida de calor.
El calor y el chirrido de un grillo
Parte del calor de una máquina como la de Carnot se pierde, se disipa en el medio ambiente. El calor generado por los músculos de un grillo para crear su chirrido se esfuma en la noche, igual que su pequeño ruido. El calor que acompaña la caída de una pluma disminuye y pronto desaparece. La mayor parte del calor así perdido lo es irreparablemente, no es nunca más capaz de efectuar un trabajo.
La conclusión de este juego de perder nos obliga a enfrentarnos con el día en que toda la energía del universo se habrá convertido en calor, y todo ese calor se habrá distribuido uniformemente a través del universo. Eso no quiere necesariamente decir que el universo se habrá vuelto muy frío; podría estar tibio o al rojo blanco. La cuestión es que estará a la misma temperatura por todas partes. Y eso quiere decir, finalmente, que no se puede efectuar más trabajo.
Para describir esa nivelación de calor, Clausius ideó la palabra «entropía», de la palabra griega que indica «cambio», como medida de hasta qué punto está nivelada la energía del universo.
Palabras tales como «flujo» y «bajada» recuerdan la teoría del calórico, y ciertamente el modo más fácil de comprender la entropía es en tales términos. Pero lo mismo que los movimientos moleculares se encuentran en la base de todos los demás fenómenos caloríficos, así también explican la entropía. Cuando se da entrada a las moléculas de vapor en la cámara del pistón de una máquina, están todas ellas, por decirlo así, dirigidas en una dirección. Eso no significa que todas las moléculas estén orientadas de la misma manera, sino sencillamente que la dirección general de todas las moléculas es en el mismo sentido.
CÓMO HACER TRABAJAR AL CALOR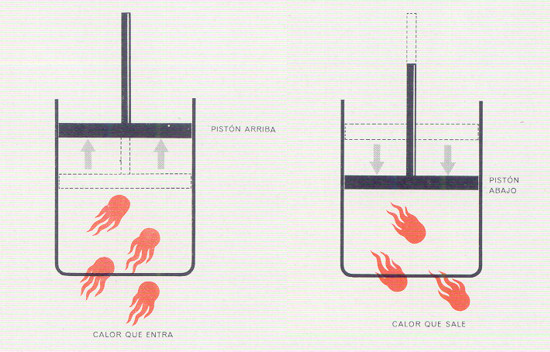
PÉRDIDA INHERENTE AL TRABAJO. Aquí encima mostramos, en forma simplificada, dos fases del funcionamiento de una máquina de vapor. Primero el vapor entra en el cilindro, se dilata, y su energía calorífica se convierte parcialmente en energía mecánica que eleva el pistón. En lo segunda fase el calor restante es expulsado del cilindro. Se retira menos calor del que se introdujo porque parte se utilizó para el trabajo realizado y parte se perdió inevitablemente por fricción.
Existe un movimiento ordenado de las moléculas, y es ese empuje concertado el que mueve el pistón. Pero tan pronto como se libera ese mismo vapor y pasa de la máquina al medio ambiente, aquel movimiento ordenado desaparece. Las moléculas del vapor chocan con las moléculas del aire y entre ellas, luego se dispersan progresivamente en el espacio, y poseen cada vez menos energía.
Carnot dijo que el calor tiene que fluir de lo caliente a lo frío para producir trabajo. Y podríamos añadir que las moléculas tienen que moverse de algún modo ordenado para producir trabajo. Pues así como la máxima entropía es aquel punto en que toda temperatura es la misma, también puede definirse como el punto en que el movimiento molecular es completamente desordenado. En ambos casos ningún trabajo sería posible y también en ambos casos el universo habría muerto.
¿Cuándo se producirá la entropía máxima? Los científicos difieren en sus predicciones; algunos dicen que varios miles de millones de años. En todo caso, el hombre, tal como hoy existe, no se encuentra en peligro. Cada vez aprende a utilizar nuevos recursos energéticos; está aprendiendo a convertir en energía útil la sustancia misma del universo.
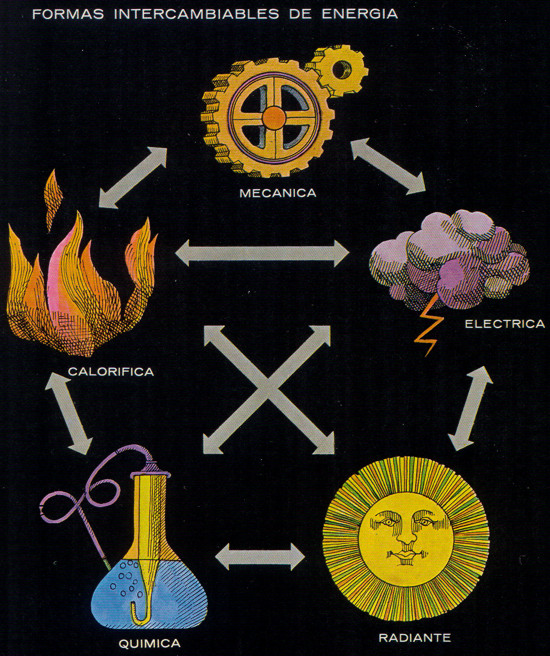
UN CICLO INTERMINABLE EN ACCIÓN. Las flechas en el diagrama indican cómo diferentes formas de energía pueden transformarse unos en otros. Lo combustión puede producir color y luz. El calor, a su vez, produce vapor, y la energía mecánica de una máquina de vapor puede ser utilizada para generar electricidad. No obstante, en cada uno de esos cambios se pierde siempre algo de calor.
Sobre todo, y debido a grandes adelantos de la física, está aprendiendo a ser más optimista en su modo de pensar. Pues como el siguiente ensayo ilustrado indica, algunos creen que puede muy bien suceder que la entropía máxima y su sombra catastrófica no lleguen nunca a producirse.
El calor, impuesto inevitable sobre lo utilizable
Cada uno de nuestros movimientos o de nuestros pensamientos, cada revolución de una rueda de automóvil, cada ráfaga de viento, se lleva un poco del caudal de energía útil para el hombre. La energía de la naturaleza no puede nunca ser destruida, sino solamente convertida de una forma a otra. Pero cada vez que se produce una conversión, parte de la energía se pierde en forma de calor inútil, que se difunde a través del universo, persistiendo para siempre, pero jamás recuperable. El descubrimiento en el siglo pasado de la inevitabilidad de esta pérdida de la energía disponible calificó definitivamente de «fútil» la búsqueda de máquinas de movimiento perpetuo, y condujo también a la verificación de que los proceso; naturales tienden a ir en una sola dirección. La medida de la progresiva degeneración de la energía hasta un estado de inutilidad se llama «entropía» y lleva consigo implicaciones de gran importancia filosófica.
Ingeniosas máquinas en inútil busca del movimiento perpetuo
Más pronto o más tarde, todo muchacho que pasa mucho tiempo con motores y generadores eléctricos tiene una idea luminosa: ¿por qué no conectar el eje del motor al eje del generador? De esta manera, piensa entusiasmado, el motor impulsará al generador, el cual producirá fuerza para hacer andar el motor.
La amarga experiencia enseña al muchacho que su hermoso proyecto no es practicable, pero entonces con frecuencia se dedica a ensayar otras máquinas mejores que deberían funcionar solas.
Aunque el joven inventor no lo sabe, no hace sino repetir los penosos pasos de brillantes inteligencias del pasado, en busca del movimiento perpetuo. Puede afirmarse que ninguna máquina de ese tipo ha funcionado nunca, a pesar de los ingeniosos razonamientos que motivaron muchos artefactos, como los de estas páginas.

UNA LECCIÓN DE LEONARDO. En este ingenio de movimiento perpetuo propuesto por Leonardo da Vinci, los globos de los brazos debían estar parcialmente llenos de mercurio, cuyo peso haría girar la rueda. Pero después de haber estudiado muchos proyectos semejantes, Leonardo escribió: «Oh, especuladores sobre el movimiento perpetuo, ¿cuántas vanas quimeras habéis creado en la búsqueda? Id a reuniros con los que buscan el oro»
Leonardo da Vinci llegó a la conclusión de que la mayor parte de tales proyectos tenía forzosamente que fracasar.
| CORREA SINFÍN DE ESPONJAS. Sir William Congreve, inventor de un cohete militar, patentó la máquina de la figura a principios del siglo XIX. La esponja, A, se empapa, B, haciéndose más pesada; una cadena, C, exprimía el agua de las esponjas en la pendiente, D, para aligerarlas. Así lo correa de esponjas debía girar sobre poleas. En realidad el esfuerzo de exprimir las esponjas anularía el aumento de peso e impediría el movimiento. |
La Academia Francesa de Ciencias, en 1775, cerró definitivamente sus puertas a todo nuevo plan para un movimiento perpetuo con la afirmación de que "esta clase de investigación... ha arruinado a más de una familia y, en muchos casos, mecánicos que hubiesen podido prestar grandes servicios han consumido en ella su fortuna, su tiempo y su ingenio".
Ni la Academia ni Leonardo conocían las leyes fundamentales que niegan la posibilidad de movimiento perpetuo. Esto llegó junto a una comprensión más completa de la naturaleza de una de las formas más elusivas de la energía, el calor.
CICLO IMPULSADO POR EL MAGNETISMO. Uno de los ingenios más sencillos y más intrigantes es éste, donde una gran piedra imán redondo, o un imán, A, debía hacer subir una bola de hierro, C, por el plano inclinado, F. Al llegar al orificio, E, la bola debía caer, deslizarse por la pendiente, G, y salir por la trampa, D. El defecto consiste en que un imán suficientemente fuerte para hacer subir la bola sería demasiado fuerte para dejarla caer. |
|
| UNA RUEDA QUE NUNCA SE DETIENE. Esta versión inglesa de la rueda desequilibrada, tenía unos largos brazos articulados, A, que al caer se enderezaban recibiendo una bola que giraba por un canal hasta C. La palanca del brazo debía desequilibrar la rueda. El brazo debería entonces subir, doblarse y depositar su bola en D. Pero en realidad la rueda está equilibrada, puesto que los brazos y bolas de la izquierda compensan la palanca de la derecha. |
UN TORNILLO QUE GIRA POR SI SOLO. Una rueda de agua del siglo XVI, .que gira sola, utilizaba el tornillo de Arquímedes, un tubo, B, que contiene un cilindro en espiral (abajo) el cual eleva agua al girar. El agua fluye por la parte superior en unas cubetas, E, F, G, y sobre unas paletas, H, I, K, unidas al cilindro, haciéndolo girar. Una de las dificultades es que parte de la energía del agua se gasta venciendo la resistencia de los ejes. |
|
Obstinado avance de la naturaleza por una calle sin retorno
A nadie se le puede ocultar que ninguna de las reacciones representadas en estas páginas puede ocurrir en sentido inverso, por lo menos no por sí solas.

Aunque hubiese un trampolín inmediatamente bajo el agua, ni el mejor saltador, una vez realizada lo zambullida, podría rebotar volviendo al punto de partida, a menos de que de un modo u otro se impulsase atrás para compensar la energía perdida por fricción con el aire.
El saltador no volverá a su trampolín; la niña no se deslizará hacia arriba, y el vapor no volverá a meterse en la cafetera. Son ejemplos de lo que los científicos llaman "procesos irreversibles".
VÍCTIMAS DEL CALOR. La energía perdida en forma de calor hace que todas estas actividades sean irreversibles. El humo que se dilata, el vapor y el aire se enfrían, disipando energía calorífica en la atmósfera. La fricción con el aire y la manguera desgasta la energía del agua; la fricción impedirá que la flecha rebote volviendo al arco. La fricción de un niño disminuye su energía.
Pero supongamos que el saltador choca con un trampolín justo debajo del agua del estanque; que la niña rebota en un muelle al final de su caída; y que de un modo u otro se hace que el vapor se comprima a sí mismo y entre en la cafetera. ¿Podrían entonces invertirse las acciones? La respuesta es: no del todo, no sin añadir nueva energía. A todas ellas puede venirles de un pelo conseguir la inversión, pero inevitablemente se quedarán siempre un poco cortas. La fricción del saltador a través del aire y del agua, y la del trasero de la niña contra el tablón generan calor. Las moléculas de vapor ceden parte de su energía al medio ambiente, en forma de calor. Un poco de esta energía calorífica eventualmente se pierde en el espacio. Incluso si el trampolín, el muelle y el compresor fuesen eficientes en un 100 %, la pequeña pérdida de calor es suficiente para hacer imposible una reversibilidad total.
El incorregible ladrón de la fuerza
La misma perversidad de la naturaleza que afecta a las máquinas de movimiento perpetuo, roba también energía de las líneas de fuerza eléctrica. Por muy perfecto que sea el conductor o por muy corto que sea el alambre de un circuito eléctrico, siempre sale menos fuerza de la que entró, debido a alguna pérdida de calor.
Cuando los experimentadores del siglo XIX investigaban la ineficiencia de sus máquinas de vapor y otras, llegaron progresivamente a la conclusión de que el culpable era el calor. Encontraron que el calor no era sino la evidencia externa de violentas colisiones de pequeñas partículas en el interior de la materia. La acción de la fricción ordinaria, por ejemplo, es semejante a lo que ocurriría si se juntasen comprimiéndolas, dos filas de automóviles que marcharan en direcciones opuestas.

El fallo progresivo de esta señal luminosa proporciona una ilustración exagerada de cómo la fuerza eléctrica va disminuyendo en su trayecto desde un salto de agua a una lejana ciudad. Turbinas ineficientes, fricción, resistencia y averías contribuyen a las pérdidas.
El movimiento ordenado se convertiría en choques y giros desordenados de los automóviles a través de la masa de vehículos.
Se ha observado que el flujo de electricidad a lo largo de un alambre consiste en electrones en movimiento, electrones que a veces chocan con otras partículas en el alambre, poniéndolas en el desordenado movimiento característico del calor. Como es natural, los electrones mismos pierden parte de su energía en el proceso.
Cuanto más largo sea el alambre, peores las conexiones y el aislamiento, tanto más rápida es esa conversión de electricidad en calor. A medida que la energía va así disminuyendo durante el viaje de la electricidad, más fuerza hay que "inyectar" a la línea, lo mismo que hay que bombear agua a una tubería que pierde. La pérdida puede ser tal, que es a menudo más barato transportar combustible a generadores eléctricos locales, que enviar electricidad a gran distancia de las fuentes de combustible. En la práctica corriente no se suele transmitir fuerza a más de 100 kilómetros.
Entropía: toque de muertos para el universo
El pelotón de soldados de la ilustración representa las moléculas del universo, al dirigirse en último término hacia la muerte; pues lo mismo que los soldados rompen filas y se echan al suelo, así las moléculas del universo se desordenan y "mueren de cansancio".
Cuando el vapor sale por una cafetera, sus moléculas se dirigen principalmente en una misma dirección, y se podría hacer fácilmente que trabajasen impulsando el pistón de una máquina de vapor de juguete; pero pocos instantes después de haber escapado al aire, el vapor se disipa y sus moléculas salen volando en todas direcciones y pierden progresivamente su energía útil.

Representamos aquí la entropía por una fila de soldados en marcha. Su formación perfectamente ordenada y su marcha en una solo dirección indican el estado de entropía mínima. Si los soldados se salen de las filas y aumenta el desorden, la entropía aumenta.
La tendencia de la naturaleza a igualar temperaturas a medida que aumenta el desorden molecular es un proceso de autodestrucción. Si no fuese por las diferencias de temperatura, ninguna de nuestras máquinas que convierten calor en otras formas de energía, máquinas de vapor, turbinas, motores de gasolina, podría funcionar. De la misma manera que el agua solamente puede hacer girar una rueda cuando fluye hacia abajo, así el calor solamente puede efectuar trabajo cuando fluye de un lugar caliente a otro lugar frío.

Aquí mostramos unas fases de la posible muerte del universo por entropía, en lo que afectan a la tierra. En la cuarta división el sol crece hasta el estado de «gigante rojo», luego se encoge convirtiéndose en un «enano blanco» y, finalmente, se apaga.
Este principio se aplica no solamente a las máquinas sino también a la naturaleza. El tiempo depende de diferencias en niveles de calor alrededor del globo. Así el viento es debido principalmente al aire caliente que se eleva y al aire frío que se precipita a ocupar su lugar.
La medida de la uniformidad con que está distribuido el calor del universo se llama entropía, palabra inventada por el físico alemán Clausius en 1865. Una entropía creciente, la dilución continua del calor y del orden, tiene inferencias cósmicas. Desde hace casi un siglo se ha venido especulando extensamente con la idea de que todo el universo puede estar tomando parte en una carrera de autodestrucción hacia una entropía máxima. Según este punto de vista tradicional tiene que llegar un momento en que todo el cosmos quede nivelado a una temperatura absolutamente uniforme. Cuando eso ocurra, todos los procesos se detendrán.
Pero últimamente esta lúgubre profecía ha perdido un poco de la implacable certidumbre que antes la acompañaba. Los físicos habían dicho que el sol no podía durar más de 200.000 años antes de quemarse por completo. Ahora, al saberse que la energía del sol procede de la fusión nuclear, calculan que puede seguir ardiendo otros 10 a 30 mil millones de años. Incluso ha habido una negativa aún más directa a la idea de que nuestro universo es mortal. Algunos astrónomos han desarrollado una teoría de "estado constante", afirmando que en las profundidades del espacio, entre las estrellas y las galaxias está siendo constantemente creada una materia que contiene energía utilizable.
Capítulo 4
En busca de los confines del arco iris
UNA LUZ FRÍA QUE NOS VIENE DEL MAR. Estos corales de las profundidades del mar se fotografiaron con luz ultravioleta en total oscuridad. La mayor parte de le luz se produce cuando los átomos se excitan y chocan unos con otros hasta emitir radiación en forma de luz y de calor. En la fluorescencia solamente son agitados los electrones de los átomos: emiten radiación luminosa, pero prácticamente no emiten calor. Así se explica la descripción de «luz fría» que se aplica en la fluorescencia.
En 15 minutos el sol irradia tanta energía sobre nuestro globo como la humanidad consume en todas las demás formas durante un año entero. Si bien ahora convertimos para nuestro uso solamente una pequeñísima fracción de este torrente de luz solar, tenemos a nuestra disposición una enorme riqueza de energía radiante y llegará el día en que podremos capturarla y transformarla a voluntad.
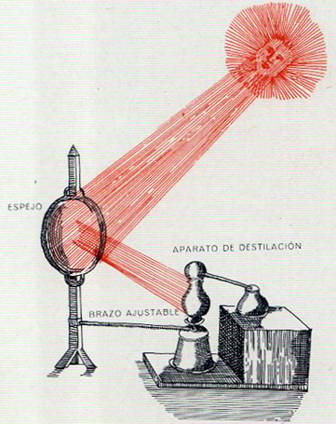
ALAMBIQUE SOLAR. Este horno solar utilizado para destilar fue descrito por Athanasius Kircher, escritor e ilustrador del siglo XVII. Después de reflejarse en un espejo cóncavo, los rayos del sol calientan el líquido en el frasco (centro) de modo que parte de él se vaporiza y luego se condensa en el jarro de la derecha. El espejo gira sobre su soporte a fin de mantener la luz solar sobre el frasco, el cual puede también subirse o bajarse por medio de un brazo ajustable
Incluso ahora, ciertas casas, especialmente diseñadas, utilizan la energía solar para reducir sus cuentas de combustible en dos tercios. También en diversos países se fabrican aparatos económicos solares de gran eficiencia para cocinar. En Mont-Louis, en los Pirineos franceses, se ha construido un horno gigantesco. En buenas condiciones atmosféricas, ese aparato produce temperaturas de más de 3000 °C, suficientes para perforar un carril de acero en 30 segundos.
Entre todas las nuevas aplicaciones de la energía solar, quizás la más importante, hoy en día, es en el campo de los satélites espaciales. Estos complejos artefactos, tanto de los EEUU como los soviéticos, están cubiertos de células solares especiales que convierten la luz del sol directamente en electricidad, utilizada en instrumentos y en transmisores de radio. Estos ingenios son tan seguros que uno de ellos, a bordo del Vanguard I, satélite del tamaño de un pomelo, lleva operando sin interrupción desde el 17 de marzo de 1958, y se espera que emita señales durante por lo menos unos 1000 años, asegurándonos así de su presencia en órbita.
Desde la antigüedad el hombre se ha dado cuenta de que la luz solar es una fuente poderosa de energía. Desde hace siglos se sabe que una sencilla lente de aumento concentra la luz del sol en un rayo tan caliente que puede prender fuego a la madera; lentes parecidas a juguetes modernos han sido halladas en las ruinas de Nínive, que datan del siglo VII a. J. En la comedia griega Las Nubes, de Aristófanes, uno de los personajes habla de enfocar una lente de aumento sobre una tableta de cera para borrar cierta evidencia escrita. Y existe la historia, sin duda apócrifa, de que Arquímedes destruyó la flota de Esparta, que atacaba Siracusa, incendiando sus velas por medio de una batería de espejos.
En los siglos XVII y XVIII los astrónomos hallaron una prueba de la fuerza de la luz al observar que las colas de los cometas parecían ser impulsadas por algún misterioso viento, y adivinaron que el efecto se debía a una especie de presión de la luz. En un intento para observar la presión de la luz sobre la tierra, suspendieron pedazos de papel muy ligeros en potentes rayos de luz. Si bien luego se ha demostrado que la idea era correcta, la presión de luz existente no era suficiente para mover el papel en aquellos experimentos. No fue sino hasta principios de este siglo cuando se dispuso de instrumentos para detectar la presión de la luz.
A pesar de lo ligera al tacto que acostumbra a ser, la luz es una de las dos formas de energía radiante que los sentidos humanos pueden percibir directamente. El ojo es un instrumento tan magnífico que puede percibir a la distancia de un palmo una milésima parte de la energía de una sola bujía. La única otra forma de energía radiante que los seres humanos pueden sentir es la llamada energía calorífica infrarroja, puesto que la piel del cuerpo humano está cubierta de terminales nerviosos que pueden detectar el calor y que, lo mismo que el ojo, son enormemente eficientes y responden hasta a 0,003 °C.
El hecho de que la energía infrarroja es una forma de luz invisible fue descubierto a principios del siglo XIX por sir William Herschel, uno de los más grandes científicos de su época, y uno de los primeros en astronomía estelar, el cual se interesó por las manchas solares y comenzó a examinar la luz con una gran variedad de filtros de diversos colores. En 1800 descubrió que si bien algunos producían un efecto calorífico, otros no lo hacían, e investigó la causa de esa diferencia. Utilizando un prisma extendió un haz de luz solar formando la banda continua de color llamada espectro, roja en un extremo, y que pasa a través del anaranjado y amarillo al verde, azul y violeta al otro extremo. Observó que el amarillo era la luz más brillante, que el rojo era el que emitía más calor, y vio con sorpresa que la mayor temperatura de todas se hallaba en radiación invisible justo por bajo de la luz roja visible. Esta luz infrarroja, «bajo el rojo», es una parte prominente de la radiación emitida por cualquier objeto caliente.
El infrarrojo como detective
Además de su importancia en lámparas caloríficas domésticas y en la terapéutica médica, donde el calor es de utilidad, el infrarrojo invisible se ha hecho, desde el comienzo de la segunda Guerra Mundial, cada vez más importante en fotografía. Ciertas películas modernas responden al infrarrojo de la misma manera que las películas ordinarias a la luz ordinaria, lo cual hace posible obtener fotografías en completa oscuridad. La intensidad de la imagen en la película varía según la temperatura de los diversos objetos fotografiados, cuanto más caliente es el objeto, tanto más brillante aparece en la fotografía.
Por razones evidentes los militares utilizan mucho las fotografías al infrarrojo en vuelos de reconocimiento destinados a localizar, gracias al calor que emiten, instalaciones tan hábilmente escondidas que serían totalmente invisibles de día.
Otra aplicación del infrarrojo, el llamado «sniperscopio», permite a un tirador de rifle ver en la oscuridad gracias a un proyector montado sobre un arma que proyecta un haz de infrarrojos, el cual se refleja volviendo a una pequeña pantalla también sobre el rifle, y muestra una imagen semejante a la TV.
EL CALOR RADIANTE HACE GIRAR UNA MISTERIOSA RUEDA DE PALETAS | |
| RADIÓMETRO REVERSIBLE. Los radiómetros giran gracias al calor radiante. En esencia, funcionan porque la parte negra de cada paleta absorbe calor radiante y se calienta: la parte clara y brillante lo refleja y permanece fría. Luego, y debido a lo «transpiración térmica», un número mayor de las moléculas del gas del interior de la bombilla se reúnen en los lados negros, determinando una presión que impulsa las paletas en el sentido de los agujas del reloj, de un modo semejante a como las moléculas calientes empujan un pistón. Cuando se enfría la bombilla, se invierte el proceso y las paletas giran en sentido contrario. |
Un año después de que Herschel descubriese el infrarrojo, el investigador alemán Johann Wilhelm Ritter observó que al otro extremo del espectro había otros rayos invisibles especialmente eficaces en reacciones químicas, y el descubrimiento de Ritter recibió el nombre de «espectro químico». El hecho de que el cloruro de plata, en particular, fuese más afectado por esos rayos que por la luz visible ordinaria, finalmente condujo a una explicación de la naturaleza exacta de aquel espectro. No obstante, eso no se debió a una investigación científica, sino a una invención comercial en grado sumo, la fotografía.
En 1839 el francés Louis Daguerre popularizó un procedimiento para hacer imágenes, los famosos daguerrotipos de la era victoriana, sobre placas de metal recubiertas de sales de plata. La ciencia pronto se aprovechó del método de Daguerre para hacer fotografías espectrales. Inscrito en las placas de plata, más allá de la banda del violeta, se hallaba un sector de radiación invisible para el ojo. Los científicos lo denominaron ultravioleta, «más allá del violeta».
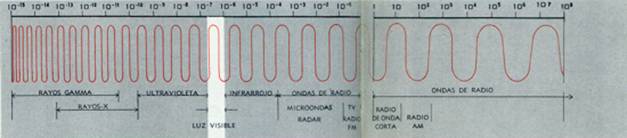
EXTENSIÓN DE LA RADIACIÓN. Esta escala representa el espectro electromagnético, desde los rayos gamma cortos hasta las ondas de radio largas. Toda la energía radiante es transmitida por ondas electromagnéticas a la velocidad de la luz. Las radiaciones sólo se distinguen por su longitud de onda. La teoría electromagnética de la radiación, propuesta por James Clerk Maxwell en Escocia en 1865, fue demostrada por Heinrich Hertz en Alemania 20 después.
La piel humana reacciona también a la radiación ultravioleta. El ultravioleta es la parte de la luz solar que produce el bronceado. Pero el bronceado no es sino un mecanismo protector. Los biólogos han comprobado que los rayos ultravioleta incontrolados matan las células de la piel blanca pura: cualquier persona de piel clara que se exponga excesivamente a los primeros ardores del verano corre el riesgo de sufrir quemaduras de tercer grado. El bronceado que el hombre blanco adquiere lentamente y la pigmentación permanente de las razas de piel oscura sirven de eficaces filtros de ultravioleta que protegen las células del cuerpo contra el daño causado por los rayos que se hallan presentes en la luz solar.
No obstante, no todos los efectos del ultravioleta son perjudiciales; entre otras virtudes, ayuda al cuerpo a sintetizar la vitamina D, y recientemente ha sido muy utilizado en forma de la llamada «luz negra», que hace que ciertas señales luminosas especiales resplandezcan en la oscuridad. La luz ultravioleta puede ser generada artificialmente. La luz de arco que se utiliza para iluminar los estudios de cine y de la TV produce esa radiación en grandes cantidades. También se ha ideado una sencilla «lámpara solar» doméstica, la cual consiste en una bombilla de cristal de cuarzo especial que contiene un poco de mercurio; cuando la corriente eléctrica vaporiza el mercurio, la incandescencia que se produce contiene luz ultravioleta. Es preciso utilizar cristal de cuarzo, porque el vidrio ordinario es opaco al ultravioleta, como sabe todo aquel que ha pretendido broncearse a través de una ventana cerrada.
Pronóstico de ondas futuras
La cuarta forma de energía radiante es la de las ondas de radio, predichas por Clerk Maxwell en 1864. En su «Tratado sobre electricidad y magnetismo», uno de los trabajos de física más importantes que nunca se hayan publicado, Maxwell demostró que una corriente eléctrica pulsativa tenía que crear en el espacio circundante un campo magnético pulsativo, y que este campo magnético crearía otro campo eléctrico, y así sucesivamente, hasta el infinito. Esta cadena de perturbaciones, afirmó, se desplazaría a través del espacio hasta entrar en contacto con otro trozo de materia donde generaría una corriente eléctrica semejante a la que inició el proceso en cadena. Calculó asimismo que tales ondulaciones, al tener un componente eléctrico y otro magnético, se moverían a la misma velocidad que la luz, y de eso dedujo que la luz misma era una forma de radiación «electromagnética».
Maxwell no había aún descubierto las ondas de la radio, ni había inventado la radio. Pero Heinrich Hertz, un físico alemán, muy pronto aplicó la teoría de Maxwell y comprobó que funcionaba. Cuando en 1888 hizo saltar una chispa entre dos terminales, observó una chispa más pequeña en un segundo circuito que había montado al otro lado de la habitación. Se dio cuenta de que las ondas que se habían desplazado a través del espacio intermedio, determinando la chispa, eran ondas electromagnéticas de una naturaleza completamente diferente; llamadas aún ondas hertzianas en su honor, son las ondas de radio actuales. Un italiano de 22 años, Guglielmo Marconi, fue el primero en adivinar su importancia comercial. Razonando que si la corriente podía pasar de un lado a otro de una habitación, también podría ser enviada a través de kilómetros de espacio, Marconi desarrolló y patentó el primer transmisor y receptor en 1896.
| DETECTOR DE GASES OCULTOS. En el curso de cinco años, de 1894 a 1898, sir William Ramsay, profesor de Química del University College de Londres, descubrió cinco de los seis elementos gaseosos inertes, argón, helio, neón, kriptón y xenón. Le fue concedida la medalla Davy de la Royal Society en 1894, recibió el título de Sir en 1902 y el Premio Nobel de Química en 1904. Esta caricatura, publicada en la revista «Vanity Fair», muestra a Ramsay en su clase con algunos de su «familia» en una tabla de elementos. |
El misterioso rayo llamado X
Un año antes, Wilhelm Konrad Roentgen había descubierto otra forma de energía radiante, identificada como rayos X. Siendo profesor de la Universidad de Wurzburg en Alemania, estaba trabajando con un tubo catódico en el interior del cual se hacía pasar una corriente de electricidad por el vacío, de un terminal a otro. Como tal tubo resplandece levemente cuando pasa la corriente, Roentgen había oscurecido la habitación para ver mejor el resplandor. De repente observó que un pedazo de vidrio cubierto con una sal de bario también resplandecía cuando el tubo funcionaba, a pesar de que estaba separado del aparato por un papel negro. Puso un libro enfrente del tubo y la pantalla siguió resplandeciendo. Utilizó luego un trozo de madera y finalmente una pieza de aluminio. Los rayos lo penetraban todo, incluso su mano. Además, cuando interpuso su mano entre el tubo catódico y una placa fotográfica, la imagen del esqueleto quedó sobre la placa. Más de mil artículos científicos sobre el nuevo rayo-X fueron publicados en el primer año que siguió a su descubrimiento.
La conmoción científica inmediata producida por el descubrimiento de Roentgen tuvo, además, otros efectos; entre ellos el de impulsar al científico francés Becquerel a reconsiderar el hecho de que ciertos compuestos de uranio fluorescen cuando son expuestos a la luz. Becquerel adivinó que aquel resplandor, estimulado por la luz solar, produciría una impresión fotográfica, lo mismo que los rayos X; envolvió una placa en papel negro, puso una muestra de mineral de uranio sobre el paquete y lo expuso a la luz solar. Al revelar la placa encontró sobre el negativo una imagen del uranio. Se dispuso entonces a repetir el ensayo, pero como entonces se nublase el sol, metió el paquete en un cajón, dejando encima de él la muestra de uranio. Luego, al revelar una de las placas que no habían sido expuestas a la luz solar, encontró que la imagen del mineral estaba tan clara como en su primer experimento, probando así que el uranio emite radiaciones tanto bajo la influencia de la luz como sin ella.
Alfabeto para la radiación
Marie y Pierre Curie, en 1897, hallaron dos elementos, polonio y radio, que tenían precisamente la misma propiedad. Un análisis posterior de la radiación reveló tres tipos distintos, que fueron llamados alfa, beta y gamma. Los rayos alfa y beta son pedazos de átomos con carga eléctrica. Por otra parte, la radiación gamma es semejante a los rayos X, pero de mayor energía y de origen muy diferente. Los rayos X son producidos por descargas eléctricas, pero los rayos gamma son producto, o bien de la desintegración de las sustancias radiactivas naturales de la tierra, o bien de otras artificiales, por ejemplo, las producidas en los reactores atómicos y las que se encuentran en el «fallout» de las explosiones de bombas atómicas.
Si bien cada una de estas formas de energía radiante, luz visible, infrarrojo, ultravioleta, radio, rayos X y rayos gamma, había sido descubierta separadamente y parecía tener propiedades distintas, el primitivo trabajo de Maxwell había establecido que todas ellas eran ondas de naturaleza eléctrica y magnética y que, consideradas en conjunto, podían ser llamadas el espectro electromagnético.
El convincente argumento de Maxwell en favor de la teoría ondulatoria de la luz pareció haber terminado para siempre un debate entre científicos, que tenía siglos de antigüedad. La idea opuesta consistía en imaginar la luz como haces formados por partículas individuales. Platón había afirmado que el ojo emitía partículas que rebotaban en los objetos que se encuentran en la visión normal. Esta idea platónica fue rechazada por vez primera desde los tiempos antiguos en 1666, cuando el matemático italiano Francesco Grimaldi comparó la reacción de la luz al comportamiento de las ondas en un líquido. Doce años más tarde, el eminente astrónomo y físico holandés Christian Huygens publicó su «Traité de la Lumière», en el cual se pronunció también en favor de la teoría ondulatoria.
Entretanto, sir Isaac Newton y Robert Hooke habían tomado parte en el debate, y después de años de estudios, Newton propuso la teoría de que la mejor manera de explicar todos los fenómenos luminosos era considerando que la luz consistía en partículas. Si bien él indicaba nuevos caminos a investigar, durante un siglo sus seguidores se mantuvieron irreductibles en sostener la teoría corpuscular de la luz, hasta que Thomas Young, utilizando el postulado de Huygens con extraordinaria habilidad, anunció inequívocamente en 1801 que la luz está compuesta por ondas. Había descubierto que un rayo de luz, dividido en dos, podía ser reunido produciendo bandas alternas de luz y oscuridad, efecto llamado «fenómeno de interferencia». Esto no podía explicarse con la teoría de las partículas.
No obstante, Young había contrariado a la vieja guardia de la ciencia británica, y la augusta Edinburgh Review proclamó que las ideas de Young eran peligrosas para el progreso de la ciencia y «desprovistas de toda clase de mérito». Confiado en la exactitud de sus observaciones, Young publicó una refutación de la que se vendió un solo ejemplar, pero fue reivindicado después de otro medio siglo de experimentación imaginativa, que finalmente culminó en la brillante afirmación de Maxwell de que la luz es una onda electromagnética.
Solamente 25 años después de que Maxwell pareció haber zanjado la controversia onda-contra-partícula, en favor del concepto de onda, se descubrió nueva evidencia que volvió a abrir el debate. Fue el descubrimiento del «efecto fotoeléctrico», fenómeno que hoy se utiliza en los aparatos de ojo eléctrico que abren y cierran puertas en supermercados y garajes. Sabiendo que se crea electricidad cuando la luz hace desprender electrones de la superficie de los metales, el físico alemán Phillipp Lenard observó que un aumento de la intensidad de un haz ultravioleta no parecía aumentar la velocidad con que los electrones salían del metal. Además, no observó efecto fotoeléctrico alguno al utilizar un rayo de luz roja o infrarroja puras. Era algo así como si un carpintero hubiese hallado un clavo que solamente pudiese ser clavado de un martillazo de bastante fuerza, no siendo posible clavarlo con muchos martillazos más débiles. Las observaciones de Lenard no se explicaban con la teoría ondulatoria, y fue esa perturbadora observación la que llamó la atención de Albert Einstein.
Energía en pequeños paquetes
Einstein conocía el reciente descubrimiento del físico alemán Max Planck de que la radiación calorífica es absorbida o emitida solamente en forma de pequeños paquetes de energía llamados cuanta.
UNA VISIÓN DANESA QUE ABRIÓ PERSPECTIVAS ATÓMICAS
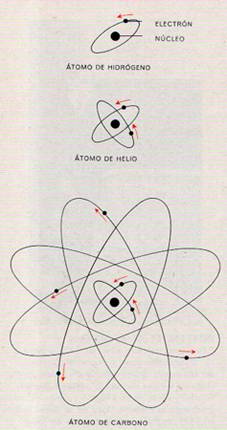 | EL SISTEMA SOLAR MÁS PEQUEÑO. Niels Bohr, gran físico danés que murió en 1962, imaginó al átomo como un pequeño sistema solar donde los electrones se mueven en órbitas circulares fijas alrededor de un núcleo. El físico alemán Arnold Sommerfeld sugirió órbitas elípticas, según se ilustra arriba. Si bien los conceptos modernos de la estructura atómica son más complejos, se considera todavía que la teoría de Bohr-Sommerfeld es una útil representación visual simplificada. |
En su revolucionario trabajo de 1905, Einstein dijo que la luz debe comportarse de la misma manera, y afirmó que la luz de cada color estaba constituida por paquetes que contenían cantidades diferentes de energía. Estos cuantas de luz recibieron más tarde el nombre de fotones.
Los fotones ofrecían una explicación parcial a la extraña observación de Lenard, pues decía que se necesitaba cierta cantidad de energía para hacer saltar un electrón de la superficie del metal, y más energía para que saliese volando al espacio.
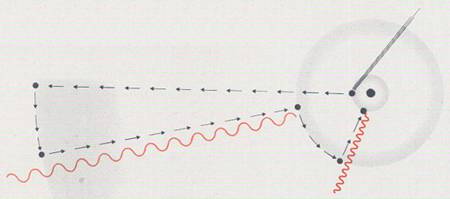
JUEGOS ATÓMICOS. El electrón activado descrito más arriba, puede saltar más de una órbita y luego volver paso a paso en vez de en un salto. Al volver de una órbita externa a una intermedia, el electrón, encontrándose más lejos de la atracción del núcleo, emite menos energía que en su salto siguiente a una órbita interior. La longitud de onda de la luz, que depende de la energía, es más larga para el primer paso que para el segundo.
Según la explicación de Einstein, la luz roja no estaba compuesta de fotones con suficiente energía para producir aquella acción, pero sí la ultravioleta; tampoco era posible que dos o más fotones pequeños se uniesen para producirla. Cada fotón podía, o no, hacerlo.
El trabajo de Einstein no tenía por objeto hacer que los físicos volviesen por completo a la teoría corpuscular, ya que actualmente las teorías corpuscular y ondulatoria coexisten en una armonía casi perfecta. Para describir el sector de radio del espectro electromagnético, la palabra ondas parece más adecuada, mientras que la descripción como partículas es más conveniente para las ondas cortas y compactas como las gammas y las de rayos X. La luz visible, que en cuanto a tamaño se encuentra entre aquéllas, posee una doble personalidad, pues su comportamiento parece a veces el de una onda y a veces el de una partícula.
El descubrimiento de que la luz consistía en paquetes definidos de energía, constituye la clave de la respuesta a la última cuestión que quedaba sobre la energía radiante: ¿de dónde procede?
El primer paso hacia una solución fue dado hace 50 años. En 1913 el joven físico danés Niels Bohr, que era ayudante de lord Ernest Rutherford en el Cavendish Laboratory, presentó una serie de audaces hipótesis sobre la naturaleza de la materia, las cuales le situaron entre los grandes físicos de nuestro tiempo.
Un sistema solar infinitesimal
Partiendo del modelo del átomo de Rutherford y aplicando la teoría cuántica de Planck, Bohr representó el átomo como una especie de sistema solar con un núcleo rodeado de electrones en órbita. Pero mientras que los planetas son mantenidos en sus trayectorias alrededor del sol por la gravitación, Bohr sabía que los efectos gravitatorios entre partículas atómicas eran pequeños para mantener juntos electrones y núcleos. La atracción eléctrica entre partículas cargadas positiva y negativamente servía para tal fin.
La contribución de Bohr al concepto del átomo consistió en establecer que el número y diámetro de las órbitas permitidas a los electrones es fijo. Por ejemplo, en el hidrógeno, está permitida una órbita de un diámetro 1/100.000.000 de centímetro, así como órbitas de un diámetro 4, 9, 16 y 25 veces mayor que aquella órbita interior.
Entre esas órbitas, toda otra órbita está prohibida. Normalmente un electrón permanece en su órbita permitida sin radiar ni absorber energía, pero los electrones pueden saltar de una órbita permitida a otra.
Cuando un electrón salta, se produce una variación de su energía. Cuando uno de ellos pasa a una órbita más alejada del núcleo, «sube» eléctricamente, lo cual quiere decir que hay que realizar un trabajo: tiene que absorber energía de alguna fuente exterior. Si pasa a una órbita más cercana al núcleo, ese salto hacia «abajo» va acompañado de un desprendimiento instantáneo de energía igual a la diferencia entre los niveles de energía de las dos órbitas. Estas concentraciones de energía son fotones, y éste es el mecanismo general gracias al cual se produce y se absorbe luz.
LOS ELECTRONES PRÓDIGOS RETORNAN BRILLANDO
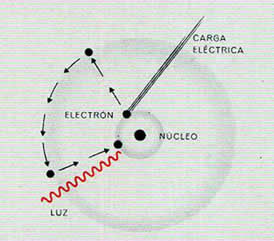 | LO QUE HACE QUE BRILLE BROADWAY. Las principales calles de todo el país resplandecen por la noche debido a las acciones excitadas de pequeños electrones en el gas neón de los anuncios luminosos. Cuando una descarga eléctrica encuentra un electrón (arriba) de un átomo de neón, aquél absorbe la energía y salta de su órbita normal alrededor del núcleo a uno nueva órbita solamente temporal. Al volver, el electrón desprende en forma de luz, la energía absorbida, es decir, resplandece. |
Las órbitas electrónicas posibles rodean al núcleo algo así como capas concéntricas, una dentro de otra. Los electrones pueden saltar, no solamente a la órbita siguiente, sino a órbitas bastante apartadas. En el hidrógeno, las transicciones de las órbitas externas a la más interna producen fotones de gran energía que originan rayos ultravioleta. Transiciones de las órbitas externas a la tercera órbita afectan a menos energía y producen fotones en el infrarrojo.
Cuando el núcleo atómico es más pesado que un protón solo, o sea el hidrógeno, tiene una carga naturalmente mayor. Para apartar de él a un electrón se necesita más energía, y, por lo tanto, se desprende más energía en las transiciones orbitales a posiciones cercanas a los núcleos de metales pesados, que son más densos. Cuando los electrones efectúan transiciones en esta región de alta energía, se producen rayos X. Por ello los blancos de los tubos de rayos X se hacen con los metales más pesados.
Para todos los elementos existen órbitas semejantes a las del hidrógeno, y su tamaño exacto depende del volumen y de la fuerza de la masa cargada eléctricamente que se encuentra comprimida en el núcleo. La órbita más externa nunca contiene más de ocho electrones, y la más interna nunca más de dos, mientras que algunas órbitas intermedias contienen hasta 32. El sodio, por ejemplo, posee 11 electrones: dos en el anillo más interior, ocho en el segundo, y el restante electrón, en el tercero. Y como cada elemento tiene una estructura orbital diferente, los fotones que emite son característicos y explican los colores espectrales individuales de cada elemento.

EL COLOR ILUMINADO. A media luz, los colores se desvanecen y aparecen o lo visto corno sombras grises y negras. En lo fotografía de enfrente, la parte de la derecha muestra de que manera aparecerían a la vista unas rosas rojas en lo luz de fondo de poca intensidad. Pero la película fotográfica es capaz de registrar el color en mejores condiciones que la visto, como se ve en el lado izquierdo.
Si bien ondas y fotones parecen ser algo completamente contradictorio, los físicos han aprendido a calcular problemas de radiación con una precisión asombrosa. La teoría moderna del espectro electromagnético, llamada electrodinámica cuántica, es un ejemplo notable de la capacidad del físico para predecir el resultado de experimentos, a pesar de la imposibilidad de representar en términos no matemáticos los conceptos básicos, o de defender de modo satisfactorio la base lógica de la teoría.
El mundo extraño y espectral de la luz
Como nuestro mundo está en gran parte definido por la luz, el hombre siempre se ha sentido fascinado por sus asombrosas y brillantes fantasías.
Para el físico, la luz no es más que una forma de energía radiante medida en longitudes de onda ordinarias. Pero para la mayoría de las gentes, luz, al proyectarse sobre el mundo, quiere decir brillo y sombra.
Desde la antigüedad los hombres han fabricado lentes y otros cristales ópticos para dominar a la luz, y los rayos de luz han respondido en innumerables y fantásticas formas, revelando curiosos mundos generalmente ocultos a la vista: formas que se doblan o quiebran, aumentan o encogen; colores que se convierten en sus opuestos, o aparecen donde no había ninguno. En la naturaleza estos caprichos determinan fenómenos fantasmagóricos. En la máquina fotográfica pueden ser igualmente seductores, según muestra esta serie, debida a Nina Leen, fotógrafo de LIFE.

HUEVO DE LOS COLORES DEL ESPECTRO. Sobre la cáscara de huevo (arriba) se superponen rayos de luz roja, verde y azul, produciendo los colores del espectro. El diagrama de más abajo muestra el aspecto de la misma combinación de colores extendidos sobre una superficie plana. En la parte superior del huevo, donde los tres colores se mezclan uniformemente, el resultado es el «color total, blanco. Debido a que las luces roja, verde y azul, además de sumarse dando blanco, pueden producir todos los demás colores, los físicos los han denominado colores primarios. Existe, otra terna de colores, pueden verse más arriba, donde los colores primarios se superponen, que pueden producir también todos los demás colores y que el artista ha tomado para sí como colores primarios. Pero para el físico esos últimos son los colores complementarios de la luz, pues cada uno se forma por mezcla de dos de los tres primarios.
Longitudes de onda que pinta el mundo del hombre
En toda luz hay presencia de color: la luz blanca que parece no tener color, es en realidad la suma total de todo color. En efecto, si bien la luz del sol suele parecer blanca, cuando pasa a través de la atmósfera a veces revela sus muchos colores extendiéndolos en forma de espectro, o arco iris. Por la misma razón resulta posible confeccionar luz blanca mezclando luces de colores, como la parte superior del huevo de la izquierda.

La luz consiste en radiaciones u ondas electromagnéticas de diversas longitudes de onda, pero el ojo responde a esas radiaciones convirtiendo cada longitud de onda en un color específico. Además, el ojo convierte mezclas de radiaciones en nuevos colores. En el huevo se ven más colores que los tres que inciden en él.
Además de colorear nuestras percepciones, los matices pueden determinar nuestro humor y afectar nuestros gustos. Una vez, una extraña cena lo demostró: cuando se sirvió a los invitados con luces que hacían que la carne pareciese gris, el apio rosado, los guisantes negros y el café amarillo, la mayor parte de aquéllos no pudieron comer absolutamente nada.
Pigmentos: color por sustracción
Los colores de casi todo lo que vemos son producto de pigmentos, pero los pigmentos no son la fuente de los colores, sino sencillamente sustancias que eliminan o "substraen" todos los colores de la luz excepto algunos específicos: el pigmento verde, por ejemplo, es verde porque absorbe todos los colores de la luz blanca excepto el verde, reflejando la longitud de onda verde que nosotros vemos.
| COLORES EN CÍRCULO. Una rueda coloreada tal como la de la arriba muestra las relaciones entre colores primarios y complementarios. Los tres segmentos mayores de la rueda nos dan los colores primarios de la luz. Frente a cada color primario está su complemento. Así el amarillo lo es del azul; el azul verdoso del rojo, y el magenta es complemento del verde: cada uno de ellos es una mezcla de los colores primarios adjuntos |

LOS COLORES VUELTOS DEL REVÉS. En el negativo coloreado de la derecha, las intensidades de luz son el inverso de las de la copia de encima, como ocurre con un negativo en blanco y negro. Esto se debe a uno paradójica propiedad de la película fotográfica: lo claro se convierte en oscuro en el negativo. Es pues necesaria otra inversión para conseguir una imagen verídica. De un modo semejante, los colores del negativo de la derecha están invertidos. La verdadera nariz es roja con algo azul, de modo que en el negativo lo nariz es azul verdosa menos aquel algo de azul
Así el pigmento negro lo vemos como negro porque absorbe casi toda la luz, mientras que el pigmento blanco refleja la luz.
Mucha gente sabe que los nombres del artista para los colores primarios son: rojo, azul y amarillo.

No obstante, para el físico, esos colores ni son primarios, ni están bien denominados: los primarios del artista deberían ser denominados magenta, azul verdoso y amarillo, pues son ellos los complementos de los verdaderos primarios de la luz, según se explica en la rueda coloreada de más arriba. Cuando se revelan fotografías en color (observar fotografías del payaso) se ve que los colores primarios de pigmento en el negativo se reproducen en una copia como los colores primarios de la luz.
Falsas imágenes en un vaso de agua
Las divertidas ilusiones ópticas representadas en estas páginas, la cara del gato en un vaso de agua y las cucharas rotas o desaparecidas, son debidas a la refracción, o desvío, de la luz.
Un vaso de agua obra como una lente, y la luz se dobla a su paso por él, como muestran los diagramas. Las cucharas, vistas a través del agua, aparecen ampliadas y desplazadas. La cara del gato está invertida, de manera que los verdaderos bigotes, que pueden verse por fuera, y a la derecha, del vaso, aparecen a la izquierda en su interior.
| UN GATO AL REVÉS. En el diagrama de la izquierda, la luz de la imagen amarilla de un gato (arriba) se tuerce al pasar por el vaso, de la misma manera que lo haría al pasar por una lente (zona azul). La luz que pasa por el centro de la lente no se dobla, pero la que se aparta del centro se tuerce de tal manera que se vuelve a enfocar fuera de la lente. Los rayos procedentes del lado izquierdo del gato (negro), se enfocan a la derecha, y los de la derecha (rojo), a la izquierda. Como el vaso no está frente al gato, la imagen se ve invertida y deformada. |
Todas las lentes refractan la luz. Sus diversos efectos dependen de su curvatura y del índice de refracción, la facultad de desviar los rayos de luz. Al utilizar la refracción, el hombre ha ideado varios aparatos, lentes, telescopios, microscopios, máquinas fotográficas y proyectores.

AGUA QUE ROMPE CUCHARAS. El desplazamiento aparente de las cucharas en la fotografía de encima se debe al desvío de la luz que muestra el diagrama de la derecha. La parte de cuchara por encimo del agua se ve, como es natural, en su verdadera posición. Pero el agua actúa como una lente (zona azul) cuyo eje central viene representado por la línea que une los dos puntos azul oscuro. La luz que se refleja de una cuchara (punto rojo) pasa sin desviarse a través del eje de la lente, pero se tuerce al pasar por cualquier otro parte de lo lente. Así, en el diagrama, la cuchara parece encontrarse en la posición del círculo rojo, en lugar de la del punto rojo. Una de las cucharas de encima, vista a través de dos vasos, ha sido desplazado dos veces y parece estor en un vaso que no le corresponde.
Luz blanca y arco iris
Cuando en 1666 Isaac Newton oscureció su habitación e hizo pasar una pequeña hendidura de luz a través de un prisma triangular, efectuó "la observación más considerable hasta ahora realizada del funcionamiento de la naturaleza". En el espectro coloreado producido a partir de la luz blanca contempló "la más sorprendente y maravillosa composición... de blancura".

Newton no había sido el primero en observar la luz blanca dividida de tan hermosa manera, pero sí fue el primero en tener la idea de que la luz está compuesta de diversos rayos coloreados que se tuercen en proporción diferente al pasar a través del cristal. Demostró además que si se hacía pasar los rayos refractados a través de un segundo prisma, el haz resultante volvería a aparecer de un blanco puro.
CISMA EN UN PRISMA. El diagrama de lo izquierda representa el poso de lo luz a través de un prisma. Para simplificar, solamente se representan las longitudes de onda de ambos extremos del espectro. Al extremo izquierdo se muestran ondas de luz rojo y azul moviéndose por el mismo camino hacia el prisma. Lo distancia de cima a cima es mayor para el rojo que para el azul, pues lo luz roja es de longitud de onda mayor que la azul. Lo que sucede cuando lo luz entra en el prisma se indica dentro del circulo negro. Las ondas luminosas se tuercen al entrar en el prisma. La onda azul se tuerce más que lo roja. Los ondas se vuelven a torcer al salir del prisma y se produce lo separación de colores.
Actualmente los físicos saben que tal refracción ocurre porque cada longitud de onda o color de luz se mueve a través del cristal con diferente velocidad, según muestra a seguir. El arco iris, por ejemplo, es un espectro que se forma cuando la luz blanca es refractada por pequeñas gotitas de agua suspendidas en el aire. Esta característica de la refracción perturbó a los fabricantes de lentes durante mucho tiempo. Las lentes refinadas de hoy en día corrigen este defecto utilizando un grueso de cristal para corregir la refracción de otro, de la misma manera que tanto tiempo antes Newton recompuso la blancura de la luz refractada.
Haciendo que la luz vuelva la esquina
Como la refracción, la difracción es un fenómeno que se basa en la desviación de la luz. Los espectros que sobrevuelan la rosa de la figura son productos de la difracción.

Como la luz se propaga en ondas, puede torcer en torno de bordes o esquinas agudas, lo mismo que las olas del mar giran alrededor de un espolón. Es posible doblar de esta manera la luz con una rejilla de difracción, pantalla plástica provista de miles de surcos microscópicos opacos. Cada longitud de onda de luz se dobla en proporción diferente en los bordes de los surcos, convirtiendo así la luz en espectros coloreados.
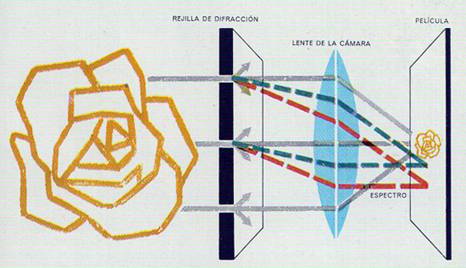
EL ESPECTRO DE UNA ROSA. Los espectros de encima de la rosa en la fotografía son una clara demostración de que todos los colores se hallan presentes en la luz blanca. Cuando, según se indica en el sencillo diagrama de encima, se coloca una rejilla de difracción entre la rosa y la lente de la cámara fotográfica (sombreado azul), parte de la luz (rayas grises) pasa directamente a través de las tirillas y se enfoca sobre la película al extremo de la derecha. Otra luz se desvía junto a las tirillas: la luz, la longitud de onda más corta de la luz visible (línea punteada azul oscuro), se desvía sólo ligeramente, y es enfocada por la lente justo por debajo de la rosa; el rojo, la longitud de onda media no representada se desvía entre esos extremos, formando el espectro completo. El diagrama muestra solamente rayos individuales de azul y de rojo, pero en realidad los innumerables rayos de luz se extienden en todas direcciones.
Espectros de difracción semejantes aparecen en un disco de larga duración (vinilo) puesto bajo un haz de luz; los microsurcos del disco difractan parte de la luz formando sobre la superficie pequeños arcos iris. El hecho de que una sombra no es tan definida como el objeto que la proyecta, por muy pequeña de tamaño que sea la luz, se debe también a la difracción.
La difracción de la luz es prueba de que se mueve en ondas. Pero los físicos han demostrado que en ciertos casos la luz se comporta como si no estuviese compuesta de ondas sino de partículas. Uno de los más apasionados debates en la historia de la física se centró en esta discrepancia. Quedó resuelto en 1920 gracias a ciertas luminosas matemáticas que demostraron que la luz es al mismo tiempo ondas y partículas. Ahora, cuando están bromeando, los físicos hablan de las "ondículas".

Plásticos que ordenan las desordenadas ondas
La luz, que puede ser reflejada, refractada y difractada, puede también ser polarizada. En general; cuando las ondas luminosas se mueven hacia adelante, vibran también en todas direcciones, radiando, como los rayos de una rueda alrededor de un eje. Pero cuando están polarizadas, sus vibraciones se limitan a un estrecho plano, según indica el diagrama de más abajo. La polarización se produce por el paso de la luz a través de plásticos moldeados, cristales, o incluso de la atmósfera superior. La luz reflejada por los espejos también está polarizada. A simple vista no se puede distinguir entre luz polarizada y luz ordinaria. Pero los filtros polaroides, que se utilizan en cámaras fotográficas y en gafas para sol, reducen el resplandor porque pueden detener la mayor parte de la luz polarizada.
Cuando la luz pasa a través de plásticos moldeados, donde la luz es a la vez polarizada y refractada, el uso de un filtro polaroide revelará sus colores al prisma, como en la fotografía siguiente. La disposición de dichos colores revela tensiones internas en el plástico.
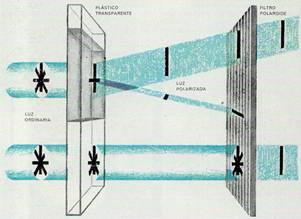
FILTRACIÓN DE LUZ REVUELTA. Las vibraciones de la luz, perpendiculares al eje del movimiento de avance de la onda, se presentan generalmente en todas direcciones, según representan las líneas negras del extremo izquierdo del diagrama superior. En la parte inferior del diagrama, un rayo ordinario de luz blanca (sombreado azul) pasa sin modificarse a través de un plástico transparente, y encuentro un filtro polaroide (gris) a la derecha. El filtro solamente permite el paso de un plano de vibración y, por lo tanto, la luz ordinaria que pasa a través de un plástico sujeto a tensión, como en la fotografía anterior. En este medio la luz polarizada en dos planos a ángulo recto el uno del otro, y los dos haces polarizados son refractados a ángulos diferentes (fenómeno llamado de «doble refracción»). Solamente uno de los haces polarizados, el que está en un plano vertical, puede pasar a través del filtro de la derecha: el otro es eliminado.
Capítulo 5
Grandes rendimientos de la química en acción
PIROTECNIA PARISINA. Esta brillante exhibición de fuegos artificiales sobre el río Sena, en París, es un ejemplo del uso decorativo de la energía química que se libera en todos los procesos de combustión. Los colores se deben a la combustión de sales de potasio mezcladas con otros metales: estroncio para el rojo, bario para el verde, sodio para el amarillo y cobre para el azul.
Volad sobre América en avión y veréis cómo las grandes carreteras cruzan el continente, salpicadas de automóviles en movimiento. Las máquinas de los automóviles, movidas por rápidas explosiones de gasolina mezclada con aire, pulsan con energía química. Los pistones, palancas, ejes de marchas y de propulsión convierten suavemente la energía química de cada explosión en la energía cinética de las ruedas en movimiento.
A lo largo de las carreteras se extienden las granjas, los pueblos y las ciudades. En invierno un penacho de humo se eleva de la chimenea de casi todas las casas, señal de que el carbón, el petróleo o el gas están ardiendo y liberando su energía química, almacenada en forma de calor.
Luces eléctricas brillan por las ventanas, y los rótulos de neón dan color a las calles principales. Pero seguid la red de alambres eléctricos a lo largo del paisaje, y en la mayoría de los casos veréis que terminan en una gigantesca planta generadora donde la energía química del carbón, del gas o del petróleo se convierte, por combustión, en energía eléctrica.
Observad las pequeñas manchas de vida, allá abajo: gentes, animales, plantas. La energía que acciona su movimiento, su crecimiento, su reproducción, toda ella procede de la energía química de los alimentos.
De todas las formas de energía ninguna es tan útil y tan fundamental para la vida del hombre como la energía química. Gran parte de su utilidad la debe a la diversidad de sus usos. A veces, como en los combustibles corrientes, tales como el carbón o la madera, la energía química se desprende tan fácilmente que lo único que se necesita para liberarla es una cerilla ardiendo. Pero también hay energía química latente en un brillante que no arde hasta calentarlo a 650 °C. Esta forma de energía puede ser controlada con facilidad por un ama de casa, pero puede ser explosivamente incontrolable, como cuando está encerrada en dinamita o TNT. Una página de este mismo libro está lentamente liberando energía química al combinarse con el oxígeno del aire, y se vuelve imperceptiblemente más caliente que el medio ambiente. Si se conservase este libro quizás cien años, sus páginas amarillearían a consecuencia de esa lenta combustión. Por otra parte, los finos hilos de metal de la bombilla del flash de un fotógrafo se queman instantáneamente con un brillo cegador.
La energía química se crea cuando se rompen los complejos enlaces que cementan la materia. Los átomos están fuertemente unidos entre sí, formando moléculas, y las moléculas están aglomeradas formando los pedazos de materia, que son lo suficientemente grandes para ser vistos y tocados. Así, por ejemplo, un átomo de oxígeno se une firmemente con dos átomos de hidrógeno, formando una molécula de agua. Y muchas moléculas de agua se juntas para formar gotas de lluvia, copos de nieves u océanos. Cada enlace entre átomos y moléculas es una fuente potencial de energía.

COMBUSTIBLES QUÍMICOS. La combustión, u oxidación, es una forma de reacción química enormemente útil. Estos dibujos muestran tres sustancias corrientes, los cuales, al combinarse químicamente con oxígeno, emiten energía calorífica. La cantidad de calor producida se da en kilocalorías por kilogramo (una kilocaloría, Kcal., es igual a 1.000 colorías). Estas reacciones necesitan energía para iniciarse, una cerilla para un fuego o una lámpara de petróleo; bujías para un automóvil.
Para comprender por qué algunas sustancias poseen más energía química y la liberan más fácilmente, es en primer lugar necesario recordar algo de química fundamental. Según se explicó en el capítulo anterior, Niels Bohr había representado el átomo como una especie de sistema solar en miniatura. El sol es el núcleo y los planetas son electrones. El núcleo tiene una carga positiva y los electrones una carga negativa. La positiva y la negativa se compensan y el átomo es, por lo tanto, eléctricamente neutro.
Como Bohr ya indicó, los electrones no giran al azar alrededor del núcleo, sino que se mueven en órbitas solamente a distancias determinadas. Si pudiésemos aumentar un átomo unos cien millones de veces, podríamos decir que algunos electrones giran a 2 centímetros del núcleo; otro grupo de electrones gira a 4 centímetros de distancia, luego otros más giran a 6 centímetros, y así sucesivamente. Si bien los electrones pueden pasar de la órbita de 2 centímetros a la de 4, nunca giran permanentemente en el espacio intermedio, digamos, a una distancia de 3 centímetros.
Estas órbitas no forman planos bidimensionales, como la de la tierra alrededor del sol, sino que forman a modo de capas esféricas, una dentro de la otra, envolviendo al núcleo.
Formación de una colección de capas
No es sólo el tamaño de las órbitas lo que está limitado, sino también el número de electrones que cada capa puede mantener. En todos los átomos, la primera capa, la más pequeña y más cercana al núcleo, queda completa con sólo dos electrones. La capa siguiente tiene ocho. La tercera, 18. La cuarta, 18 ó 32. El más reciente de los elementos fabricados por el hombre, el lawrencio, tiene átomos con 103 electrones dispuestos en siete capas. Pero cualquiera que sea el número de electrones de un átomo, la capa externa nunca contiene más de ocho.
Esas capas se llenan de electrones, de la misma manera que los automóviles llenan los espacios de un aparcamiento alrededor de un supermercado. En los átomos pequeños, por lo menos los más cercanos al núcleo se llenarán primero, y solamente entonces se encuentran electrones en las capas externas. El hidrógeno, por ejemplo, tiene solamente un electrón, que circula por sí solo en la primera órbita, donde hay sitio para dos. El helio, un gas raro que se utiliza en globos, tiene dos electrones, los cuales llenan por completo la primera órbita. El siguiente por orden es el litio, un metal ligero que se utiliza en las bombas de hidrógeno y que tiene tres electrones, dos en la primera órbita y uno en la segunda.
El comportamiento químico de los átomos depende casi por completo del número de electrones que giran en su capa externa; es una influencia desproporcionada la que ejercen esas pequeñas partículas y solamente posible debido a la complicación de las fuerzas que mantienen entero el átomo.
Por encima de todas las demás fuerzas se encuentra la atracción del núcleo positivo por todos los electrones, negativamente cargados, que le rodean. El núcleo atrae constantemente hacia sí esos electrones, mientras que los electrones giran con justo la velocidad suficiente para evitar caer al centro, de la misma manera que un satélite terrestre tiene que mantenerse en movimiento para evitar caer sobre la tierra. Pero además de esta atracción positiva, cada electrón del átomo repele a los demás electrones, siendo esto así porque todos ellos tienen carga negativa, y las cargas negativas se repelen entre sí. En una sustancia como el helio, que tiene solamente dos electrones, los dos giran sencillamente en su propia esfera, tratando de mantenerse lo más lejos posible el uno del otro. Pero en un átomo como el del uranio la situación es muy compleja, porque allí hay 92 electrones, cada uno de los cuales trata de acercarse lo más posible al núcleo positivo, y al mismo tiempo de mantenerse lo más lejos posible de cada uno de los demás. Tal geometría sería complicada incluso si ninguno de los 92 se moviese, pero con todos ellos moviéndose a velocidades de 2.500 kilómetros por segundo, los equilibrios resultan complicadísimos.
El número máximo de electrones que se puede encontrar en cada capa parece determinado por el equilibrio de conjunto del átomo. Desde el punto de vista del átomo, es la forma más fácil y estable de reunir todos aquellos electrones. En cuanto tal disposición se ve perturbada por una capa sin completar, todas las dificultades de mantener entero el átomo aumentan enormemente.
En su precario equilibrio, un átomo es algo así como un automóvil estacionado en una cuesta empinada; es estable, pero podría serlo mucho más. Una de las maneras en que un átomo puede «deslizarse por la pendiente» es uniéndose con otro átomo. Cuando dos átomos se unen, los electrones de sus capas externas se intercambian, o se comparten. Hay varias maneras en que tal cosa puede efectuarse, pero el resultado neto es que cada uno de los átomos ha conseguido una mayor estabilidad cuando su capa externa incompleta se ha completado. Por ejemplo, el sodio, con su electrón externo único, se une fácilmente con el cloro, que posee siete. Siete y uno son ocho, el número de electrones requerido para formar una capa externa completa.
En el capítulo 1 se utilizó el ejemplo de un automóvil en una pendiente para explicar el fenómeno de la energía potencial. Cuando el automóvil se deslizaba hacia abajo, liberaba energía: de un modo semejante, cuando un átomo se desliza por la pendiente para combinarse con otro, se libera energía química, y la forma en que acostumbra a aparecer es el calor.
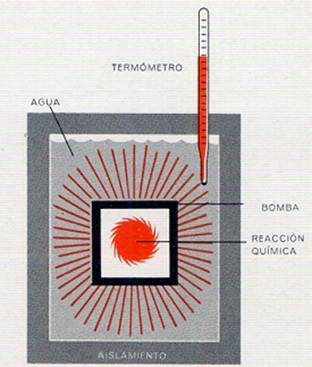 | MEDIDA DEL CALOR CON UNA «BOMBA» Este esquema representa un calorímetro de bomba, sencillo aparato que determina la cantidad de calor liberado en una reacción química, tal como las reacciones de oxidación descritas en la página anterior. El aislamiento evita la pérdida de calor, y el termómetro mide el aumento de temperatura del agua después de producido la reacción. La caja interior recibe el nombre de «bomba» porque las reacciones que se producen en ella son generalmente tan rápidas que casi son explosivas. |
Medidas en una bomba
No existe manera ninguna directa de medir la cantidad de energía encerrada en los enlaces eléctricos que mantienen unida una molécula; pero es posible determinar cuánto calor se desprende cuando una molécula se forma o se descompone durante una reacción química. Los aparatos para efectuar tales medidas, llamados calorímetros, fueron inventados en el siglo XVIII. Una de las versiones modernas de esos aparatos es la llamada «bomba» calorimétrica, y consiste en poco más que en un bote bien aislado, con un pequeño recipiente suspendido en su interior. El calor que se produce al reaccionar las sustancias aumenta la temperatura del agua, y la variación se lee en un termómetro. La unidad de medida es la caloría, que corresponde a la cantidad de calor necesaria para elevar la temperatura de un gramo de agua un grado centígrado. Los números de todas las tablas del contenido en calorías de los alimentos se confeccionan de esa manera, se quema una muestra del alimento y se miden los grados que aumenta la temperatura del agua. (La Caloría de alimentos, con una «C» mayúscula, es 1.000 veces mayor que la caloría científica, que se escribe con «c» minúscula.)
Para describir cuantitativamente reacciones químicas, no sólo tenemos que calcular la cantidad de calor desprendida, sino que también es preciso atribuir un «peso» a cada átomo y molécula. Las medidas generalmente utilizadas son el peso átomo-gramo y el peso molécula-gramo. Cada átomo tiene cierto peso en relación con cada uno de los demás átomos, y el peso de una molécula es el peso de todos los átomos que la componen. Se ha tomado como peso patrón el del carbono ordinario, y se ha fijado arbitrariamente su peso en 12. Comparado con el carbono, el hidrógeno, que es el más ligero de los elementos, pesa 1,008, el oxígeno, 15,999, y el uranio, 238,03. Una molécula de monóxido de carbono pesa 28, que es la suma de sus componentes: un átomo de carbono, a 12, más uno de oxígeno, a 16. Un peso átomo gramo o molécula gramo es sencillamente el peso atómico o molecular expresado en gramos. Un peso átomo-gramo de carbono es 12 gramos; un peso molécula-gramo de monóxido de carbono es 28. El gramo, aunque es científicamente conveniente, es de elección arbitraria, puesto que la unidad podría ser también la molécula-onza, o molécula-tonelada. Los ingenieros americanos, con frecuencia, utilizan todavía un peso molécula-libra.
Importancia de una buena corriente de aire
No es fácil determinar directamente el calor desprendido en la oxidación de carbono a monóxido de carbono, pero para simplificar supongamos que ponemos un átomo-gramo de carbono en el calorímetro con media molécula-gramo de oxígeno; si se hace entonces pasar una chispa a su través, se combinan violentamente formando monóxido de carbono, ese gas tan peligroso de los escapes de los automóviles. Si se pudiese aislar esa unión encontraríamos que se desprenden 26.400 calorías; ésta es energía calorífica ordinaria, que podría utilizarse para calentar una casa o para mover una locomotora. Pero el monóxido de carbono puede ser a su vez oxidado formando dióxido de carbono (gas inofensivo que forma las burbujas de las gaseosas) y desprendiendo 67.600 calorías de calor. Así pues, en la oxidación de carbono a dióxido de carbono se producen un total de 94.000 calorías. Esta misma reacción, combinación del carbono con el oxígeno, ocurre en todos los hornos de carbón ordinarios, pues el carbón es carbono casi puro. Cuando hay una buena corriente de aire que proporciona abundante oxígeno, el fuego no solamente arde, sino que desprende más calor y es menos probable que produzca el mortal monóxido de carbono.
El hidrógeno reacciona también con el oxígeno, y el resultado es óxido de hidrógeno, agua. La reacción es explosiva, produciéndose fuerte ruido cuando se hace pasar una chispa a través de la mezcla de gases, y el resultado son unas pequeñísimas gotitas de agua y 68.000 calorías de calor.
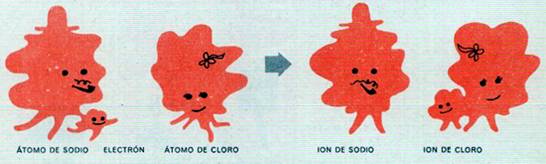
UNIONES MOLECULARES: CEDIENDO...Si representamos a los átomos como padres, y a un electrón como un niño, las caricaturas representan una unión iónica, uno de los dos enlaces químicos fundamentales. El electrón salta de un átomo al otro y forma dos iones, átomos cargados eléctricamente por haber ganado o perdido un electrón, que están unidos por fuerzas electrostáticas. Un ejemplo es la sal: un electrón del sodio se une a un átomo de cloro formando cloruro de sodio.
Podría parecer que el hidrógeno produce menos calor que el carbón, puesto que solamente desprende 68.400 calorías, frente a las 94.000 del carbono, pero, gramo por gramo, es mucho más eficiente. Si bien es combustible demasiado explosivo para uso doméstico, los expertos no lo pierden de vista, y los planes americanos para un disparo a la luna comprenden una máquina impulsada por hidrógeno-oxígeno en su segunda fase.
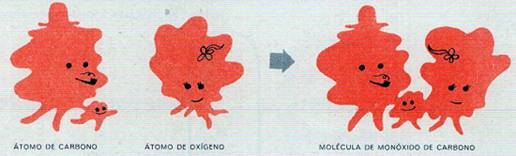
...Y COMPARTIENDO. En las uniones covalentes los electrones son igualmente compartidos por los átomos padres. Eso ocurre generalmente cuando ambos átomos poseen cuatro o más electrones en su órbita externa y necesitan uno o más para ser estables, como en la unión del carbono y del oxígeno para formar monóxido de carbono (CO). Como en la mayor parte de las relaciones, determina uno unión estable. La unión covalente es más fuerte que la iónica.
Si bien el carbono y el hidrógeno son combustibles moleculares muy sencillos, el mismo proceso de reacción se produce con moléculas más complicadas, cuando se quema petróleo, gas natural y numerosos alcoholes. De todos esos, el gas natural es el que desprende más calor.
Todas las reacciones arriba descritas incluyen oxígeno, pero ese gas no es en absoluto necesario en todas las reacciones químicas. El hidrógeno y el cloro reaccionan con igual facilidad, desprendiendo unas 22.000 calorías y produciendo un gas, cloruro de hidrógeno, que a su vez se disuelve en agua, formando ácido clorhídrico (el ácido que se encuentra en el estómago humano). El metal sodio también reacciona con cloro, formando sal de mesa común y liberando 98.000 calorías. Uno de los mayores calores de reacción es el que resulta de la unión del hidrógeno y del gas flúor, que es de color amarillo claro y terriblemente corrosivo, el más reactivo de todos los elementos. Si bien los compuestos de flúor son tan corrosivos que tienen que ser conservados en botellas especialmente recubiertas, se utilizan pequeñas cantidades de fluoruro de sodio para evitar la caries dental. Cuando se combinan hidrógeno y flúor, se desprenden más de 128.000 calorías, y si bien esta unión violenta es también de interés para los expertos en cohetes que investigan nuevos combustibles, los problemas de controlar el flúor han hecho hasta ahora prácticamente imposible su utilización.
No todas las reacciones químicas desprenden calor, y en algunas reacciones es necesario añadir calor de fuentes extrañas. Las reacciones se llaman exotérmicas cuando emiten calor, y endotérmicas, cuando lo absorben.
Si bien el hidrógeno y el oxígeno reaccionan fácilmente formando agua, hace falta aplicar un enorme calor para descomponer el agua en hidrógeno y oxígeno. Si se calienta a 3.000 °C, doble de la temperatura necesaria para fundir el acero, solamente se rompe una cuarta parte de las moléculas de agua. Casi lo mismo es cierto para el dióxido de carbono, la sal, o cualquier otro de los compuestos corrientes, porque las moléculas que los componen son más estables que los átomos libres.
En todos los casos las reacciones siguen la Primera Ley de Termodinámica. Para romper una molécula se necesita exactamente el mismo calor que se desprende al formarla. Si el hidrógeno, al reaccionar con el oxigeno, produce agua y 68.400 calorías, se necesitará el mismo número de calorías para fragmentar el agua dando hidrógeno y oxígeno. Las reacciones químicas siguen también la Segunda Ley de Termodinámica, la cual dice que la energía del universo tiende a ser cada vez menos útil. Lo mismo que ocurre en la naturaleza, esas reacciones se mueven en dirección a un punto en el que las moléculas contienen una cantidad mínima de energía. En otras palabras, las reacciones químicas representan una búsqueda de la máxima estabilidad molecular.
El científico americano Willard Gibbs, durante mucho tiempo profesor en la Universidad de Yale, estableció las fórmulas que pusieron por fin a la química bajo la jurisdicción de la Segunda Ley. Su hazaña, anunciada en un par de publicaciones científicas en 1878 y 1879, es prácticamente desconocida del público, pero entre los científicos se la considera como la mayor conquista de la ciencia americana.
| DIVISIÓN FRACCIONADA. Al refinar petróleo en bruto, se comienza por la destilación fraccionado aquí representada. Calentado a unos 365 °C, el petróleo entra en la torre fraccionadora en .forma de vapores y líquidos calientes. Los vapores se elevan y se condensan en diversas cubetas, según las temperaturas a que se convierten de vapor en líquido. Las fracciones más ligeras no se condensan hasta que llegan a las cubetas más frías: algunos gases son expulsados y otros se condensan volviendo como «reflujo» (parte superior); las fracciones pesadas se condensan en las cubetas inferiores. El residuo queda abajo |
El trabajo de Gibbs fundó toda una nueva rama de la química, la química física, que trata principalmente de la manera como se comporta la energía en las reacciones químicas. Es el desarrollo de la química física lo que ha hecho posible toda la industria química moderna.
Fuego sin cerillas
Al llegar a este punto podemos preguntarnos por qué se necesita una cerilla para encender un fuego, si la unión del carbono y del oxígeno por sí sola debe producir una nueva y más estable configuración molecular. Por la misma razón, ¿por qué hay que hacer saltar una chispa a través de una mezcla de hidrógeno y oxígeno en un calorímetro? La pregunta es complicada y la respuesta debe comenzar con la afirmación de que el carbono se combina con el oxígeno sin necesidad de fuego, y que el hidrógeno hace lo mismo con el oxígeno. Pero la velocidad de tales combinaciones es extraordinariamente lenta, casi imperceptible. Por ejemplo, los diarios viejos tienden a volverse amarillentos y quebradizos. Como el papel es un carbohidrato, el amarilleamiento es el resultado de la oxidación o combustión lenta del carbono y el hidrógeno. Si el calor no puede escapar, su intensidad aumentará, lo cual explica por qué el servicio de incendios constantemente nos recomienda no dejar trapos engrasados abandonados por la casa. Pues la grasa es otro compuesto de carbono que se oxida en contacto con el aire, y cuando se ha acumulado suficiente calor llega a inflamarse la grasa, proceso que recibe el nombre de combustión espontánea.
Podríamos formular la pregunta más concretamente: ¿por qué cuando aplicamos una llama al carbón, éste arde más de prisa que si no lo encendemos? Un pedazo de carbón es, en cierto modo, una gran molécula de átomos de carbono dispuestos ordenadamente unos junto a otros y mantenidos en posición por la atracción de los átomos de carbono entre sí. De la misma manera, el oxígeno del aire está formado por átomos de oxígeno muy próximos unos a otros. Pero la unión química se produce solamente a escala atómica, de manera que para que el carbón pueda combinarse con el oxígeno, o sea, para que arda, las moléculas de carbono y de oxígeno tienen que fragmentarse en átomos. Esta rotura es lo que ocurre cuando se aplica una llama al carbón. El calor de la llama hace que los átomos de carbono de la superficie del carbón vibren cada vez más de prisa, y lo mismo ocurre con los átomos de oxígeno próximo al carbón. Finalmente, llega un punto en que todos ellos vibran con suficiente rapidez para separarse y volverse a combinar. Al ponerse en marcha este proceso, el calor que se genera es suficiente para que otras moléculas se vayan rompiendo en reacción en cadena.
Además del calor, la luz es otra fuente de energía externa que puede iniciar una reacción química. Por ejemplo, en el proceso fotográfico se forma una imagen sobre la película cuando la energía de la luz incide sobre una capa de bromuro de plata y comunica energía a las moléculas para que se fragmenten, formando plata (que aparece negra en el negativo). El cloro y el hidrógeno son tan sensibles a la luz que estallan cuando se les pone juntos, en un local muy iluminado; conservados en la oscuridad, se quedan tranquilos.
Otra característica de las reacciones químicas es la de ser aceleradas por sustancias llamadas catalizadores, entre ellas óxido de hierro (herrumbre), platino y cobre, que toman parte en reacciones, pero que terminan inalteradas. Cuando se ha terminado una reacción en una retorta química, los catalizadores quedan exactamente en la misma cantidad, y completamente inalterados, a punto de ser utilizados en otra reacción. Una reacción catalizada es de lo más económico en la naturaleza, y no es sorprendente que los catalizadores sean fundamentales en la mayoría de los procesos químicos industriales más importantes y más rentables del mundo.
Quebrantamiento del bloqueo aliado
Antes de la primera Guerra Mundial, por ejemplo, todos los nitratos usados en explosivos y fertilizantes se obtenían de los pocos depósitos de sales de nitrato que existen naturalmente en la tierra, los mejores de los cuales se encuentran en los grandes yacimientos de nitro de los desiertos de Chile.
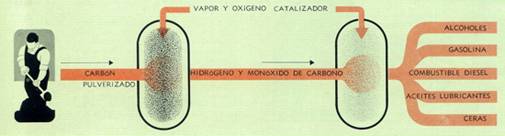
PETRÓLEO DE UNA MINA DE CARBÓN. Pensando en el día en que se sequen los pozos, la industria del petróleo está investigando este método de convertir el carbón en gasolina y otros productos. El carbón pulverizado, calentado en un generador con vapor y oxígeno a 1.100 °C (a la izquierda), produce una mezcla de hidrógeno y monóxido de carbono llamada «gas de síntesis». Esta mezcla, con un catalizador y en un reactor, se convierte en hidrocarburos gaseosos y líquidos.
Cuando llegó la guerra, una de las principales estrategias de los aliados consistió en impedir las importaciones alemanas de ese nitro a fin de ahogar la fabricación de municiones de Alemania y disminuir su producción de alimentos. Pero en 1913, inmediatamente antes de la guerra, un químico alemán, Fritz Haber, había desarrollado un método de laboratorio para producir amoníaco, producto nitrogenado importante, sencillamente haciendo pasar aire caliente e hidrógeno a unos 500 °C, sobre hierro finamente pulverizado. El nitrógeno del aire se combina con el hidrógeno formando amoníaco. Esta unión es prácticamente imposible sin el catalizador. A las temperaturas necesarias para las reacciones no catalizadas, el amoníaco se descompone tan rápidamente como se forma. Los alemanes, tan faltos de nitratos, inmediatamente ampliaron a escala industrial el aparato de laboratorio de Haber, y finalmente redujeron a un mínimo los efectos del bloqueo aliado.
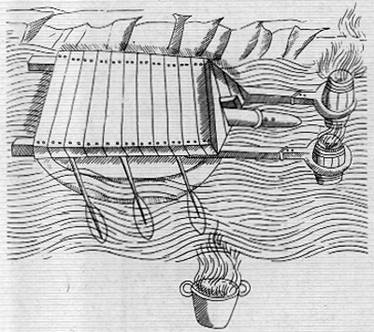
BARCO DE FUEGO. El «fuego griego», sustancia muy combustible a base de alquitrán, nafta o azufre, fue utilizado en la guerra naval y militar mucho antes de que el hombre llegase a sospechar que la combustión representaba liberación de energía química. Luego, alguien tuvo la idea de combinarlo con los arietes, y el resultado fue esta extraña nave, probablemente de origen medieval. Unos barriles de azufre ardiendo flanquean el ariete; un techo inclinado protege de la caída de fuego, de flechas y lanzas.
En realidad, el proceso de síntesis del nitrato ha sido desde entonces desarrollado con tanto éxito que actualmente los nitratos naturales son de poca importancia y casi todos los compuestos nitrogenados, para explosivos o fertilizantes, se fabrican artificialmente.
El catalizador funciona porque puede actuar como intermediario temporal en las reacciones que facilita, como el vendedor de verduras al mayor que recibe por la mañana un camión de mercancías, las envasa en paquetes para distribuir durante el día a las tiendas al por menor, y al llegar la noche cierra con el almacén de nuevo vacío. El hidrógeno y el nitrógeno del proceso de Haber existen como moléculas que no se combinan entre sí, si se las deja por sí solas. Por lo visto, el hierro las altera de forma que son mutuamente mucho más receptivas. Es posible que tanto el hidrógeno como el nitrógeno se combinen por un instante con el hierro y que, al hallarse el uno junto al otro, se unan, dejando al hierro libre para combinarse con más moléculas y continuar el proceso.
Si bien los catalizadores parecen ir contra el curso de la naturaleza, tienen buen cuidado de obedecer las Leyes de la Termodinámica. Por ejemplo, cuando el hidrógeno se combina con el nitrógeno en presencia de óxido de hierro, el amoníaco resultante es una molécula más estable.
Síntesis a partir del sol
De todos los compuestos que existen en la naturaleza, los más importantes para la humanidad como fuentes de energía química son, con mucho, los que contienen carbono. Todos los combustibles importantes, carbón, petróleo, gas, madera, alcohol, contienen carbono, lo mismo que todos los principales alimentos, azúcares, almidones, proteínas, grasas. Todos los combustibles y los alimentos son productos de cosas que han vivido, cuerpos muertos, productos secundarios, cuerpos descompuestos de plantas y animales. Ello es debido a que todos los combustibles y todos los alimentos son los productos finales de plantas, a su vez depositarias primarias de energía química que han producido de la energía radiante del sol. Esta transformación se produce en plantas durante el notable proceso químico llamado fotosíntesis, que utiliza como materias primas agua y dióxido de carbono. El agua se absorbe del suelo a través de las raíces, el dióxido de carbono del aire a través de las hojas. La planta procede luego a dividir el agua, y junta el hidrógeno al dióxido de carbono, formando una nueva molécula que contiene carbono, hidrógeno y oxígeno, llamada carbohidrato. Esta sencilla molécula de carbohidrato se convierte en uno de los carbohidratos más comunes: el azúcar.
Lo notable de esta fotosíntesis es que la planta consigue algo que para un químico resulta difícil de hacer con 3.000 °C: dividir una molécula de agua. Tras este milagro se halla otro tipo de catalizador, el pigmento verde, la clorofila. En el proceso de romper el agua, la planta consume gran cantidad de energía, que previamente ha absorbido del sol. Excitada al ser expuesta a la luz del sol, la clorofila vibra rápidamente, actuando como una especie de martillo que quebranta la molécula de agua.
La ineludible Primera Ley de Termodinámica nos dice que la energía necesaria para fraccionar una molécula es igual a la energía que se obtiene cuando la molécula se vuelve a recomponer. Cuando comemos hidratos de carbono y los quemamos en nuestros cuerpos, volvemos a reconstruir la molécula de agua, y la energía que obtenemos de los alimentos es el producto de la reunión.
Las plantas y los animales son capaces de formar sus propios tejidos partiendo de carbohidratos y un puñado de otras sustancias. Así, por ejemplo, muchas moléculas juntas del tipo del azúcar forman la celulosa, C6H12O6 y la de la celulosa puede ser C6.000H10.000O5.000. Ningún animal de gran tamaño tiene los catalizadores necesarios para fraccionar la madera y obtener su energía. Pero ciertos microorganismos, no mucho mayores que las bacterias, encuentran la madera apetitosa y nutritiva. Estas pequeñas criaturas viven en los intestinos de las termitas, desintegran la madera que la termita come, y comparten su energía química con su anfitrión. De modo semejante, la vaca come hierba y los organismos que viven en uno de sus cuatro estómagos desintegran la hierba lo suficiente para que la vaca pueda digerirla.
Las grasas y las proteínas pueden también construirse partiendo de carbohidrato. Al actuar sobre el azúcar para producir grasas, el cuerpo consigue eliminar parte del oxígeno del azúcar. Si la fórmula del azúcar es C6H12O6 una grasa característica es C57H104O6, donde hay muchos menos átomos de oxígeno por átomo de hidrógeno que en el azúcar.
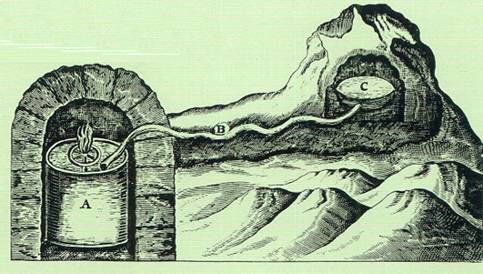
UNA LÁMPARA DEL NILO. En su libro .Cosas notables relativas o los egipcios, el escritor árabe medieval Sciangia explicaba cómo construir una lámpara que ardiese eternamente utilizando una fuente natural de petróleo. Desde la cuba C, situada en un charco formado por las filtraciones de petróleo, una tubería de plomo, B, lleva el combustible a la cuba A, cerrada y provista de una mecha. .Es evidente., dijo Athanasius Kircher, en 1665, «que esta lámpara jamás se extinguiría».
Esto significa que cuando el cuerpo «quema» grasa para obtener energía, se produce más energía que cuando quema azúcar, puesto que hay muchos más átomos de hidrógeno disponibles para combinarse con oxígeno. Esta es la razón por la cual las grasas engordan y son una fuente tan buena de energía.
Pobreza de las proteínas
Las proteínas son principalmente utilizadas por los animales para formar la carne de sus cuerpos y no tienen, ni mucho menos, la energía utilizable de las grasas. Además de carbono, hidrógeno y oxígeno, todas las proteínas contienen nitrógeno. Cuando el cuerpo desintegra proteínas se enfrenta con el problema de eliminar el nitrógeno; como no puede hacerlo en forma de gas, lo combina en un cuerpo llamado urea, que se excreta en la orina. Desgraciadamente la urea contiene también parte de la energía de la molécula de proteína original, que se pierde por lo que se refiere al animal.
Cuando se muere una planta o un animal, la preciosa energía química contenida en las células de su cuerpo queda repentinamente disponible para volver a ser usada. Bacterias, mohos, y algunos animales mayores se precipitan sobre el cadáver y lo devoran. Pero a veces ocurre que residuos vegetales o animales quedan enterrados por un corrimiento de tierras. El carbón y el petróleo son residuos fósiles de ese origen. El carbón está generalmente compuesto por los troncos, raíces, ramas y hojas de gigantescos árboles que crecieron en pantanos poco profundos hace 250 millones de años.

ASFIXIADA POR LA RIQUEZA. Dondequiera que se encuentra petróleo, no se perdona nada. La casa deshabitada rodeada de torres, en la foto, es una víctima de los hombres del petróleo que se precipitaron sobre Signal Hill, cerca de Long Beach, California, en la carrera del petróleo de 1921. Cambiaron la faz de la tierra con miles de torres sobre uno de los campos más productivos del país.
Al morir se hundieron en el cenagoso fondo, que los cubrió, y luego el tiempo y la presión de la tierra acumulada sobre ellos, convirtió paulatinamente las formas de los troncos en la masa negra homogénea de una veta de carbón. No obstante, con frecuencia pueden reconocerse porciones de árboles en el carbón que se utiliza para usos domésticos. El petróleo es probablemente el residuo de una antigua vida animal acuática que se hundió al fondo de algún primitivo océano y que quedó enterrada.
Estos depósitos subterráneos de carbón y de petróleo son realmente energía heredada de otras edades. A medida que la población del mundo ha ido aumentando, y las necesidades industriales de energía han crecido aún más rápidamente, esos depósitos insustituibles de combustible sólido han sido explotados despiadadamente. Los expertos estiman que no queda en la tierra carbón y petróleo más que para hacer funcionar las máquinas de los hombres durante unos cuantos centenares de años. Para reemplazarlos será necesaria una nueva y más abundante fuente de energía.
Dones diversos y vitales del petróleo
El petróleo ha sido llamado «oro negro», pero ningún metal precioso puede igualar los infinitamente diversos usos del petróleo. Escondido en la tierra en inmensos depósitos, donde se formó hace millones de años partiendo de los restos de miles de millones de microorganismos, el petróleo fue descubierto por el hombre allá donde rezumaba a la superficie. La demanda de esta maravillosa sustancia fue aumentando, y en 1859 Edwin L. Drake perforó el primer pozo comercial de petróleo, iniciando un auge que aún perdura. En 1859 el consumo de petróleo por cabeza en los EEUU era un dedal. Hoy en día es una industria de seis mil millones de dólares que emplea dos millones de personas y extrae casi cuatro mil millones de barriles de petróleo al año; conduce sus productos a través de 1.300.000 kilómetros de oleoductos y conducciones de gas y satisface el 75 % de todas las necesidades de energía de los EE. UU.
El despertar de un joven gigante
El petróleo no era desconocido en los Estados Unidos antes de empezar las perforaciones. En distritos tales como el Oil Creek, Pennsylvania, donde rezumaba espontáneamente por la superficie, se le recogía con mantas y se vendía en pequeñas cantidades con fines medicinales. Pero el interés por sus enormes posibilidades comerciales no comenzó hasta que en 1855 una publicación científica predijo que el 90% del petróleo en bruto podía destilarse en forma de productos vendibles. Con este impulso, un grupo de capitalistas de Nueva York fundó la Seneca Oil Company, decididos a buscar petróleo por perforación. Edwin L. Drake, maquinista de tren retirado, fue puesto al frente de las operaciones. Junto con un ayudante construyó una casa de máquinas y una torre en una granja cerca de Titusville, Pennsylvania, y el 27 de agosto de 1859, y desde una profundidad de 20 metros, el petróleo comenzó a subir a la superficie. El pozo de Drake produjo inesperadamente nueve galones por día. En 24 horas el gran negocio estuvo en marcha. Con un espíritu semejante al de la carrera del oro de 1849, se alzaron ciudades improvisadas y se perforaron docenas de pozos. Al cabo de un año había 74 pozos en producción a lo largo de Oil Creek y a los cinco años el rendimiento diario era de 6.000 barriles.
| CÓMO EMPEZÓ TODO AQUELLO. Edwin L. Drake (con sombrero de copa) junto a la destartalada torre de madera y casa de máquinas de su famoso primer pozo. Drake no se benefició de la gran industria que inició. A pesar de una pensión del Estado de Pennsylvania, pasó sus últimos años en la miseria. |

OBREROS Y TUBERÍAS. Estos obreros forman parte de una brigada que recibía el nombre de «brigada de las tenazas», por la herramienta que utilizaban. El primer oleoducto construido con éxito fue el que iba del ferrocarril de Oil Creek a un campo situado a casi unos ocho kilómetros de distancia.

CHOZAS Y POZOS INCIPIENTES. Las operaciones de perforación se extendieron con rapidez desde el primer hallazgo en Oil Creek, al noroeste de Pennsylvania. Esta fotografía lleva grabada el nombre de la localidad que en la misma se reproduce, el cercano distrito llamado de Great Western Run.
Una invasión de nuevos productos
Al brotar de la tierra petróleo en cantidades aparentemente inagotables, los hombres de negocios buscaron mercados. Los primeros productores, mejorando las técnicas de refinación (arriba), pronto pudieron ofrecer una larga lista de productos derivados, y tentaron al público comprador con sugestivos anuncios (enfrente). Muchas refinerías destilaban petróleo para obtener kerosene para lámparas, y descartaban el residuo, pero otras elaboraban tales "desperdicios": se encontró utilidad en la nafta como disolvente para .limpiar, y sustituyó al aguarrás en las pinturas; la jalea de petróleo halló su sitio en las droguerías en forma de lociones, ungüentos y pomadas; mientras que la parafina, además de proporcionar velas baratas y mejores cerillas, se utilizaba también para sellar jaleas y recubrir píldoras — y en 1870 una firma de Nueva Inglaterra convertía 30:000 kilogramos de parafina en goma de mascar.

PRODUCTOS SECUNDARIOS EN PROFUSIÓN. En la primitiva refinería que representamos aquí encima se está calentando el petróleo en bruto de la izquierda. La parte más pesada, una especie de asfalto, cae a una cubeta sobre la mesa. Posteriores etapas producen el aceite de cilindros, para lubricar los partes móviles de la maquinaria pesada, mientras que a la derecha se repite el proceso para fabricar un lubricante más ligero llamado aceite de máquinas

EL HECHIZO DEL PETRÓLEO. Este tímido anuncio omitía advertir que el aceite de máquinas primitivo, no solamente olía mal, sino que también se inflamaba
NUEVO CAMPO PARA EL PETRÓLEO. La actriz Lillian Russell recomienda Carboline para el cabello. Prometía una nueva cabellera a los calvos, y un bigote en pocas semanas

UN CURALOTODO A PARTIR DEL PETRÓLEO. El primer producto comercial del petróleo fue puesto en el mercado por Samuel Kier, refinador de Pittsburgh. Su aceite de roca (a un dólar por botella) era una cura para el cólera, los callos, el dolor de muelas y la neuralgia.

DIENTES PARA PERFORAR A MORDISCOS. Este taladro dentado, cuyo tamaño ha exagerado la telelente de la cámara fotográfica, se llama perforador de roca. El tubo al cual está unido lo hace girar, y entonces desciende cortando capas de dura roca. Las entrelazadas ruedas, que giran por presión contra el fondo del agujero, trituran la roca; los fragmentos son impulsados hacia la superficie por medio de un lodo de productos químicos, arcilla y agua, llamado lodo de perforación, que en la foto puede verse goteando del taladro. Los taladros llegan a 30 centímetros de diámetro.
Instrumentos y técnica de una búsqueda costosa
El feroz taladro mostrado anteriormente es el arma decisiva para el asalto a los depósitos de petróleo escondidos en la tierra. Según muestra el diagrama de más abajo, el taladro perfora a través de la tierra, en un tanteo a ciegas. El costo medio de perforar un pozo es de $53.000 y requiere un equipo de unos 8.000 metros de tubería de acero, 4.800 sacos de cemento y 3.000 barriles de combustible diesel. Un pozo en un territorio donde no se ha encontrado aún petróleo tiene una probabilidad de uno en ocho de dar resultado, y solamente tres de cada 100 de tales perforaciones tienen éxito comercial. En Texas se perforó un pozo hasta ocho kilómetros de profundidad, con un costo de tres millones de dólares, y no se halló petróleo.
Tales son los riesgos de una industria que gasta más de dos mil millones de dólares al año, solamente en busca de petróleo.
PERFORANDO EN LA OSCURIDAD. La ilustración de la derecha muestra un aparato perforador y una sección transversal, no en escala, de la tierra que explora. Por la polea-corona de la parte superior de la torre pasa un cable que partiendo del tambor de arrastre vuelve luego a la gran polea movible. Esta forma un gran aparejo para hacer subir y bajar la largo serie de tuberías de perforación terminadas por el taladro. Colgando del eslabón giratorio y del gancho se halla el transmisor, barra de forma cuadrada que, cuando se pasa por la parte superior de la tubería perforada y se encaja en la mesa giratoria, hace girar toda la cordada. A medida que el taladro va profundizando se van añadiendo por arriba trozos de 9 metros de tubería, pero cuando un taladro se desgasta es preciso sacar del agujero toda la cordada. Durante la perforación se bombea hacia abajo, y por lo tubería, un lodo lubricante, que retorna por el interior de la envoltura que recubre el agujero. |
|
Un 19% de la superficie de los Estados Unidos está ahora disponible para la búsqueda, pero sólo una pequeña proporción de ella resultará económicamente interesante. En los últimos diez años la búsqueda se orienta cada vez más hacia el mar. Se están efectuando perforaciones de hasta 5.000 m. a 70 millas de la costa.
Surtidores: señales explosivas del éxito
Nadie sabe nunca lo que puede suceder cuando el taladro llega por fin a una formación que contiene petróleo. La presión puede ser tan escasa que sea preciso bombear el petróleo para sacarlo. Pero a veces toda la instalación sale volando, como en el surtidor y en la llamarada de gas que mostramos aquí.
| HERALDO DE UN GRAN NEGOCIO. El surtidor de la izquierda, de un pozo abierto el 10 de enero de 1901, en los campos petrolíferos de Spindletop, en Beaumont, inició a Texas como lo mayor región petrolífera del país. Este pozo, que produjo unos 100.000 barriles de petróleo al día durante nueve días, demostró que era posible encontrar petróleo en grandes cantidades. La torre era de madera. |
Cada año ocurren unas 25 catástrofes de este tipo, pequeña fracción de los 650.000 pozos productores del mundo. No obstante, los perjuicios se calculan en mil millones de dólares. Puede reducirse tanto la presión subterránea que pueden quedar inmovilizados en la tierra otros miles de millones de dólares de petróleo y de gas. Los daños a las instalaciones pueden también ser espectaculares: un fuego en una de ellas en el golfo de México fundió una torre de 100 metros en 40 minutos.
UN FUEGO VISTO DESDE EL ESPACIO
En Gassi Touil en el Sahara, «Red» Adair y un socio en trajes de amianto combaten el mayor incendio de la historia en un pozo de gas. Quemó más de 30 millones de dólares de gas, y si no se hubiese apagado podía haber ardido durante siglos. Llamada «El encendedor del diablo», esta torre de llamas de 140 metros de altura se veía desde 150 kilómetros.
En los primeros campos de petróleo, los surtidores eran algo corriente, y campos enteros eran a veces destruidos por los incendios. Actualmente, a pesar de que para tapar el pozo se utilizan válvulas a presión, llaves y herramientas especiales, puede aún producirse la erupción de alguna bolsa de gas perforada, y entonces la más pequeña llama convierte el chorro en un geiser de fuego, como ocurrió en el incendio del Sahara, a continuación. Cuando se produjo éste, se envió una urgente llamada al tejano "Red" Adair; él y sus hombres consiguieron apagar el fuego.
Cómo se saca el jugo al petróleo
Para poder enviar el petróleo al mercado en alguna de sus numerosísimas formas útiles, tiene que ser sometido a una completa manipulación en la refinería. Ahí, en gigantescos alambiques, mezcladores y "rompedores", se aplica calor y presión al petróleo en bruto para separarlo en sus docenas de componentes químicos. Las "fracciones", que van desde el gas de cocina hasta el asfalto, se someten luego a tratamientos especiales para adaptarlas a sus diversos usos. La factoría brillantemente iluminada, abajo, tan automática que solamente se necesitan unos cuantos hombres para hacerla funcionar, es un magnífico ejemplo de refinería moderna.


REFINERÍA CONTINUA. La refinería japonesa Tokuyama, la mayor del Lejano Oriente, trata 140.000 barriles de petróleo en bruto cada 24 horas. En el dibujo: 1, unidad purificadora de gasolina; 2, torres destilación de petróleo en bruto; 3, unidad destilación de asfalto al vacío; 4, chimenea caldera de petróleo en bruto; 5, unidad cracking catalítico; 6, unidad fraccionamiento de gasolina.
CÓMO UNA REFINERÍA EXPRIME TODA LA UTILIDAD POSIBLE DEL PETRÓLEO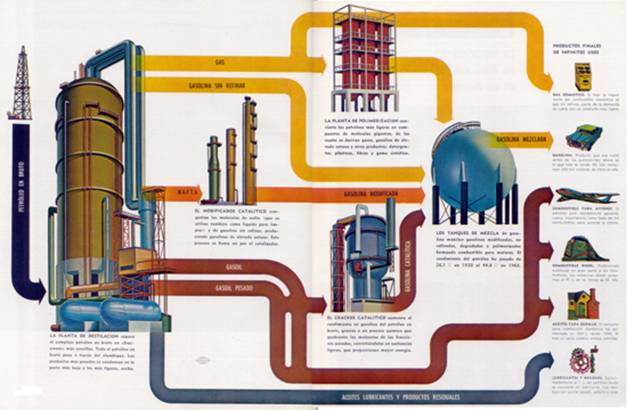
Capítulo 6
La electricidad: un dócil duende en un alambre
CHISPAS EN UN CORDEL. El grabado, obra de Currier e Ives, nos muestra cómo, en 1752, Benjamín Franklin ató una llave al cordel de una cometa, y se arriesgó a ser electrocutado para probar que los relámpagos eran electricidad. Su investigación sobre la electricidad condujo al pararrayos, e hizo exclamar a un estadista francés: «Ha robado el relámpago al cielo».
Cierto código naval medieval prescribe que si se encontrase a algún marinero manipulando indebidamente la piedra imán, «...deberá, en caso de que se le perdone la vida, ser castigado, atravesándole la mano que más utilice con una daga o cuchillo, clavándosela al mástil o palo principal de la nave...». La intención era que el castigo fuese proporcionado al crimen, puesto que la piedra imán era un pequeño pedazo de hierro magnético que servía para imantar las agujas de las primitivas brújulas gracias a las cuales navegaban los marinos de aquellos tiempos. Aquel severo código es evidencia cierta de la temprana importancia que para el hombre suponía el fenómeno del magnetismo, una de las manifestaciones más curiosas de lo que ahora llamamos energía eléctrica.
Miles de años antes de que su comportamiento fuese explicado con precisión, el magnetismo era ya familiar al hombre. A decir verdad, las propiedades magnéticas de la piedra imán, que es una variedad del mineral de hierro llamado magnetita, eran casi con seguridad conocidas de los pueblos de la Edad de Hierro. Nadie puede decir cuándo o dónde se originó la palabra «magnetismo», pero Plinio el Viejo, naturalista romano, la atribuye a un pastor llamado Magnes, quien se había asombrado de que la piedra imán atrajera los clavos de hierro de sus zapatos. Por otra parte, el poeta romano Lucrecio afirma que el vocablo magnetismo se deriva de Magnesia, nombre del antiguo país donde se dice que se halló por vez primera la piedra imán.
Teniendo en cuenta sus propiedades aparentemente mágicas, no es de extrañar que el comportamiento del imán haya inspirado una serie de complicadas explicaciones. El romano Claudio creía que el imán atraía el hierro para conseguir «alimento». Descartes, filósofo francés del siglo XVII, no fue menos imaginativo al sugerir que las sustancias magnéticas estaban cubiertas de minúsculos tornillos cuyas constantes rotaciones atraían innumerables agujeros de la superficie del hierro, y se introducían en ellos.
La clave para la comprensión de la naturaleza de la fuerza magnética se encuentra en una característica invariable de un sencillo imán de varilla. Si se le monta sobre un pivote vertical, o se le suspende de un hilo, en forma que pueda girar libremente, siempre se orientará en posición norte-sur. Debido a esta propiedad, sus extremos se conocen con el nombre de polos norte y sur. Incluso en un imán doblado en forma de herradura puede distinguirse cada extremo de modo semejante. Cada uno de los extremos se comporta de modo diferente al otro, y la diferencia aparece de modo notorio cuando se aproximan mutuamente dos imanes de varilla. El polo norte de uno de ellos atrae al polo sur del otro (y viceversa), juntándose los dos extremos. Por otra parte, cuando dos polos norte (o dos polos sur) se acercan uno al otro, se repelen mutuamente.
Lo que se deduce de todo esto sólo resulta evidente cuando se divide en dos una barra imán; cada una de las mitades se convierte en un nuevo imán, con sus polos norte y sur. Si los científicos antiguos hubiesen podido imaginar la idea de ir cortando un imán en mitades cada vez más pequeñas, hasta que cada mitad consistiese solamente en un átomo, hubiesen comprendido que el magnetismo es una propiedad atómica de la materia. Pero para una comprensión total hubo que esperar el desarrollo del conocimiento de la electricidad, de las propiedades eléctricas de los átomos y de las relaciones mutuas entre electricidad y magnetismo.
Sabemos ahora que la electricidad es la causa de una gran diversidad de notables fenómenos naturales, desde el magnetismo de la piedra imán hasta las destructoras exhibiciones de los relámpagos veraniegos. Pero hasta el siglo XIX los hombres no imaginaron la relación entre ellos.
Los antiguos griegos describieron ya una manifestación de lo que llamamos electricidad «estática», al observar que cuando se frota vigorosamente una pieza de ámbar atrae pequeñas partículas de polvo y plumas, y es de la palabra griega elektron, que significa «ámbar», de donde se deriva nuestra palabra electricidad. Más de 1500 años más tarde el mismo fenómeno volvió a despertar interés, comenzando entonces su estudio sistemático.
Entre los primeros experimentadores se encontraba Otto von Guericke, un alemán del siglo XVII, a quien se recuerda más por sus estudios sobre la presión atmosférica y los efectos del vacío. Para observar la electricidad estática, von Guericke construyó una esfera de azufre del tamaño de una calabaza, y la montó de tal manera que pudiese girar contra la mano del experimentador. Frotada de esta manera la esfera atraía pequeños pedazos de papel, tela y otras sustancias. Von Guericke observó con sorpresa que un hilo de lino sujeto a la esfera atraía lo mismo que el azufre; había conseguido crear un modesto pero verdadero generador de electricidad estática, y la primera corriente eléctrica.
A medida que fueron progresando los experimentos, se descubrió que ciertos objetos frotados contra otros presentaban propiedades parecidas a las de los imanes, salvo que su efecto era mucho menos potente. Así se llegó a la consecuencia de que la fricción creaba una llamada «carga eléctrica» de dos clases diferentes; la carga de la goma recibió el nombre de «negativa», y la carga del cristal, «positiva», de la misma manera que se habían aplicado a un imán las expresiones de polos norte y sur.
En 1785 y 1786, un físico francés llamado Charles Coulomb describió en términos matemáticos precisos cómo esas cargas positivas y negativas se atraen y repelen mutuamente. La ley de Coulomb, que se parece mucho a la ley de la gravedad de Newton, manifiesta que la atracción y la repulsión se debilitan muy rápidamente con la distancia y que aumentan con igual rapidez cuando las partículas cargadas se acercan una a otra.
Benjamín Franklin propuso los nombres de positiva y negativa para las dos cargas opuestas; Franklin mantuvo que la electricidad consistía en una especie de fluido, y razonaba que cuando un objeto poseía más que su proporción normal de electricidad, tenía una cantidad positiva de fluido; cuando contenía menos de la normal, tenía una cantidad negativa.
En su experimento ahora legendario, Franklin y su hijo elevaron una corneta durante una tempestad a fin de probar que el relámpago era de naturaleza eléctrica. En el momento en que la cometa desapareció en la amenazadora tronada, las fibras a lo largo del cordel de la cometa se enderezaron, lo mismo que ocurría en el laboratorio cuando un cordel se cargaba de electricidad estática ordinaria. De repente le saltó una chispa al dedo desde una llave metálica atada al extremo del cordel; Franklin había demostrado que la nube tormentosa, de la cual procede el relámpago, estaba cargada eléctricamente, no sin conseguir para sí la fama de ser uno de los más imprudentes experimentadores en la historia de la ciencia.
Redistribución de electrones
La moderna teoría atómica ha superado la teoría de la electricidad como fluido. Actualmente la generación de una carga eléctrica por fricción puede ser explicada por la estructura de los átomos. Según se indicó en el capítulo 5, éstos consisten en un núcleo cargado positivamente rodeado de cierto número de electrones de carga negativa.
PATAS DE RANAS A LA BOLOÑESA. En 1786, Luigi Galvani, profesor de Anatomía de la Universidad de Bolonia, observó que las chispas de una máquina eléctrica cercana determinaban contracciones en las patas de una rana que estaba disecando. Este descubrimiento accidental le condujo a numerosos experimentos. En el que aquí representamos, condujo electricidad tocando el nervio de la pata de la rana con una varilla de cinc, y el músculo con una de cobre, y estableciendo contacto entre los dos metales. Si bien Galvani atribuyó este fenómeno a «electricidad animal», condujo al descubrimiento de las corrientes eléctricas.
Generalmente todas las cargas negativas de los electrones de un átomo suman en conjunto una carga igual a la carga positiva de su núcleo, y en esa condición normal el átomo es eléctricamente neutro. Pero algunos electrones, como en la piel o en el vidrio, están débilmente sujetos y uno puede hacer que se desprendan cuando el objeto que los contiene se frota contra otro.
El resultado es que esos electrones libres pueden transferirse a otras sustancias, tales como la seda o la goma; cuando eso ocurre, la pérdida de un electrón dejará a un átomo con un exceso de carga positiva, y la ganancia de un electrón dará al otro átomo un exceso de carga negativa. En estos cambios no ocurre sino una redistribución de electrones. Las cargas eléctricas pasan de una sustancia a otra, pero no se destruye ninguna, principio que recibe el nombre de «conservación de la carga».
El estudio de los cuerpos cargados eléctricamente, llamado hoy «electrostática», no es sino como un fondo para el más complejo estudio de la electricidad en movimiento, que se llama «electrodinámica». Como herencia de la idea del siglo XVIII de que la electricidad era un fluido, se describe la electricidad en movimiento como «corriente» de electricidad.
Los orígenes de ese estudio se deben a Luigi Galvani, profesor de anatomía de la Universidad de Bolonia, quien en 1780, a consecuencia de un hecho fortuito en su laboratorio, observó por vez primera los efectos de las corrientes eléctricas. Galvani estaba disecando una rana con un escalpelo de acero, cuando un ayudante hizo saltar una chispa de una máquina de electricidad estática que se hallaba en el mismo local. Al saltar la chispa en la máquina, las patas de la rana se contrajeron repentinamente. Hoy sabemos que Galvani había presenciado un caso de «inducción electrostática». Se había producido cuando los electrones negativos, al saltar a través del aire formando la chispa, determinaron un movimiento correspondiente de otros electrones del escalpelo, que se encontraba en contacto con las patas de la rana. El movimiento de los electrones del escalpelo representaba una corriente momentánea cuya energía eléctrica estimuló los nervios de la rana e hizo que los músculos de su pierna se contrajeran.
EXTRAÑA CADENA HUMANA DEL SIGLO XVIII. Para evidenciar la electricidad estática, el doctor William Watson, imaginativo experimentador inglés del siglo XVIII, ideó esta curiosa cadena humana. Al hacer girar el hombre la rueda, éste tomaba carga electro-estática de la mano de la mujer y la transmitía a los pies del muchacho suspendido sobre cuerdas de seda. La carga posaba entonces a la muchacha, de pie sobre una tina aislante de alquitrán seco: su mano atraía la paja menuda de la mesa.
Fascinado por este fenómeno, Galvani imaginó otros experimentos semejantes, en uno de los cuales salió durante una tempestad para ver si el relámpago también haría que se contrajeran las patas de una rana recientemente muerta. Ató las patas a un gancho de latón, y colgó el gancho de una verja de hierro de su patio. Cada vez que las patas tocaban la verja de hierro, se estremecían violentamente, incluso cuando no había relámpagos. Interpretando erróneamente lo que había visto, Galvani dedujo que las patas de la rana contenían «electricidad animal».
El trabajo de Galvani fue seguido casi inmediatamente por el de Alessandro Volta, profesor de física de la Universidad de Pavía, quien en 1800 demostró lo que había realmente ocurrido en el experimento de Galvani. Había descubierto que la acción química de la humedad y de dos metales diferentes, tales como el latón y el hierro, generaba corrientes eléctricas; las patas de la rana habían sido sencillamente una fuente de humedad. Volta confeccionó la primera pila del mundo, disponiendo en capas sucesivas una serie de discos de plata y cinc separados por papel o tela empapados en una solución de sal. Al mismo tiempo, Volta generó la primera corriente continua de electricidad producida por la mano del hombre.
Una fuerza superior e invisible
Con el tiempo, el hombre llegaría a considerar las invisibles corrientes de electricidad como una nueva fuente de fuerza que le serviría incluso mejor que el majestuoso curso de los ríos y los arroyos que había utilizado desde hacía tanto tiempo para hacer girar las ruedas hidráulicas del mundo. A decir verdad, hoy nos damos cuenta de que las corrientes de electricidad se comportan en muchos sentidos precisamente como corrientes de agua. Ambas, por ejemplo, fluyen en una sola dirección. Así como el agua se desliza «hacia abajo», también la electricidad busca su camino «hacia abajo».
Solamente se produce movimiento desde un lugar con más electrones a otro con menos. Lo que llamamos corriente eléctrica no es, por lo tanto, sino un movimiento de electrones que trata de igualar una desigualdad electrónica. La medida de esta desigualdad, la diferencia entre dos concentraciones de electrones, se llama «voltaje». En términos de agua que baja por una colina, los «voltios» son la medida de la altura de la colina.
Un voltio y medio, que es la fuerza de una pila de bolsillo corriente, lo generan electrones que bajan por una pendiente muy suave. En esta situación, la cantidad de electrones en un borne de la pila no es muy diferente de la cantidad en el otro. Por otra parte, una corriente de 220 voltios, cantidad que se necesita para hacer funcionar una estufa eléctrica, se asemeja al agua que baja por una colina en pendiente pronunciada.

MOMENTO HISTÓRICO EN LA CLASE. Esta medalla representa la única ocasión en que durante un experimento en el aula se ha realizado un descubrimiento científico. En 1820, Hans Christian Oersted estaba dando clase y puso accidentalmente un alambre electrificado paralelo a una aguja magnética. La aguja respondió girando hasta colocarse perpendicularmente al alambre, revelando que la electricidad había creado un campo magnético alrededor del alambre. The American Association of Physics Teachers condecora con la Medalla Oersted a los profesores notables.
En esta analogía entre corriente eléctrica y agua corriente, es preciso hacer una importante distinción; si bien la palabra «corriente» sugiere que la electricidad fluye sin interrupción, como el agua por una manguera, los físicos saben actualmente que el movimiento es más comparable a la manera en que el agua pasa a través de una brigada de bomberos con cubos. Los electrones que forman la corriente van pasando, uno tras otro, de átomo a átomo. Al fluir a lo largo de un trozo de alambre, por ejemplo, los electrones se mueven con relativa lentitud, a veces a no más de dos centímetros por segundo. Por otra parte, en un relámpago los electrones quizá se mueven a una velocidad de 100.000 kilómetros por segundo.
Así como el voltaje mide la presión que hace que la corriente fluya, así el «amperaje» mide la cantidad de flujo. Así, cada vez que 6.242.000.000.000.000.000 electrones pasan por un punto determinado de un alambre por segundo, ha pasado un amperio de corriente.
ALUMBRANDO EL CAMINO DEL FUTURO
CÓMO ENCERRAR UN RESPLANDOR. Thomas Alva Edison, a quien mostramos en su laboratorio de Menlo Park, Nueva Jersey, había patentado miles de inventos, desde el mimeógrafo al fonógrafo y la bombilla incandescente (derecha). En la primera de sus bombillas que tuvo éxito, Edison utilizó como filamento un hilo de algodón arrollado y carbonizado. Cuando fue encerrado al vacío en una bombilla de vidrio, y conectado a una corriente eléctrica, resplandeció 40 horas.
Estas dos medidas, voltaje y amperaje, permiten observar diversos aspectos del comportamiento de las corrientes. Es perfectamente posible, por ejemplo, que un gran número de electrones fluya a través de un alambre a muy baja presión, de la misma manera que el río Mississippi pasa por Nueva Orleáns en forma de caudal voluminoso, pero lento, de agua. Se dice que tal corriente es de elevado amperaje y escaso voltaje. Por otra parte, una corriente puede ser todo lo contrario de gran voltaje y escaso amperaje, comportándose como un riachuelo de montaña que desciende a toda velocidad por un precipicio. Una máquina de soldar puede utilizar una corriente eléctrica de bajo voltaje y elevado amperaje, como de 15 voltios y 1.200 amperios. Una máquina de electricidad estática genera chispas por medio de descargas de elevado potencial, pero poco amperaje. Así, por ejemplo, una chispa necesita 15.000 voltios para atravesar unos dos centímetros de aire, pero casi ningún amperaje. Un relámpago puede combinar los más aterradores efectos del voltaje y del amperaje, con 100 millones de voltios y 160.000 amperios.
Hay otro factor que afecta el movimiento de la corriente eléctrica, y es la naturaleza de la sustancia a través de la cual pasa. En ciertas sustancias, como el cobre y la plata, los electrones están más sueltos que en otras, tales como la porcelana y el cristal, y permiten más fácilmente el flujo de la electricidad. Así se dice que el cobre y la plata son buenos «conductores». La porcelana y el cristal, que son malos conductores, reciben el nombre de «aisladores». El tamaño de la sustancia, además de su naturaleza, es de importancia en la determinación del flujo. Pues así como el agua fluye mejor a través de tuberías anchas que a través de las estrechas, cuanto mayor es el diámetro de un alambre conductor, tanto más fácilmente pueden fluir los electrones a su través.
Todo lo que tiende a impedir el flujo de electrones contribuye a la «resistencia». El primero en estudiar en detalle su naturaleza fue Georg Simon Ohm, un maestro de escuela alemán de matemáticas y física. Después de largos experimentos en los que comparó conductores de diversas sustancias, formas y longitudes, Ohm llegó a una comprensión de la resistencia eléctrica, que en su día le hizo famoso.
Al principio el trabajo de Ohm encontró dificultades; cuando publicó sus resultados en 1828, el artículo pasó inadvertido y al año siguiente, cuando publicó en Berlín un libro que contenía la derivación teórica de la ley, sus ideas no fueron comprendidas por aquellos que habían aprobado el artículo donde describía su trabajo de laboratorio. El resultado fue la impresión general de que no había base experimental alguna para su libro, y se le rechazó como «...una ilusión incurable, cuyo único objeto es rebajar la dignidad de la naturaleza...». Pero en el transcurso de los años se llegó a reconocer el valor de sus investigaciones eléctricas. Al tiempo de su muerte, en 1854, era famoso en toda Europa, y hoy en día la ley de la resistencia eléctrica, que fue el primero en formular, lleva su nombre.
Un hecho histórico
La ley de Ohm es uno de los hechos históricos en la aplicación de la electricidad a las necesidades de la civilización, pues es la resistencia la que transforma la electricidad en calor, realizando así trabajo útil. Esta transformación se produce, por ejemplo, en un tostador eléctrico, cuyos alambres de aleación de níquel y cromo convierten la corriente eléctrica en calor.
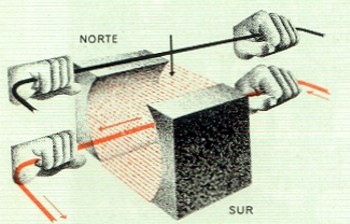
ATRACCIONES ENTRE CORRIENTES. Si se pasa un alambre a través del campo magnético cerrado entre los polos opuestos de dos imanes de barra, se evidencia el fenómeno de la inducción electromagnética. Al mover el alambre hacia abajo, la corriente eléctrica fluye a lo largo de él, hacia la derecha (flechas); cuando se mueve hacia arriba, la corriente se invierte. La velocidad del alambre en movimiento y la fuerza del campo magnético determinan la fuerza .de la corriente. Cuando cesa el movimiento la corriente también cesa.
Una serie de aparatos domésticos, desde calentadores a estufas, utiliza el principio de la ley de Ohm, que la cantidad de calor producida por un conductor varía directamente según su resistencia. La ley de Ohm explica también uno de los descubrimientos más importantes: la luz eléctrica artificial. Pues fue el fenómeno de calentamiento por resistencia lo que permitió a Thomas Edison calentar un trozo de hilo carbonizado a una incandescencia al blanco vivo, en su invención de la bombilla eléctrica.
En su efecto sobre la civilización, las transformaciones recíprocas de electricidad y calor se ven superadas por las transformaciones de electricidad y energía mecánica. Para conseguir estas últimas el hombre tuvo primeramente que descubrir la relación entre dos fenómenos aparentemente independientes, la electricidad y el magnetismo.
En 1807, e intentando relacionarlos, un danés llamado Hans Christian Oersted comenzó una larga serie de experimentos. Razonó que si se hacía pasar corriente eléctrica a través de un alambre, éste debería convertirse en una especie de imán con las propiedades de polos norte y sur. Tal magnetismo, lo mismo que el de una barra imantada ordinaria, debería ser detectado con una brújula corriente. Dispuso un alambre a través del largo de la aguja de una brújula, formando una sencilla cruz con ambos objetos. Esperaba que al magnetizar el alambre la aguja de la brújula debería girar cerca de un cuarto de vuelta, poniéndose en línea con el alambre, como ocurriría con un imán ordinario; pero cuando dio la corriente, no sucedió nada. Años más tarde, mientras estaba dando clase en la Universidad de Copenhague, Oersted accidentalmente dispuso el alambre paralelo a, en lugar de a través de, la aguja, y dio la corriente. Como por arte de magia, la aguja se movió, girando alrededor de un cuarto de vuelta, de tal modo que se puso precisamente en ángulo recto con el alambre. La corriente eléctrica había, en efecto, creado un campo magnético alrededor del alambre, y años antes Oersted sólo se equivocó al juzgar la dirección en que aparecería. Finalmente se había descubierto la relación entre electricidad y magnetismo.
Un año después del notable descubrimiento de Oersted, André Marie Ampère, físico francés en cuyo honor se nombró más tarde el amperio, descubrió que un alambre eléctrico producía un efecto magnético sobre otro alambre eléctrico situado junto al primero. Alambres paralelos con corrientes paralelas a su través se atraían mutuamente, mientras que aquellos cuyas corrientes fluían en sentido contrario se repelían. Los resultados de Ampère reforzaban la prueba proporcionada por el experimento de Oersted de que una corriente eléctrica podía crear un campo magnético a su alrededor. Pero la pregunta opuesta y más prometedora quedaba por contestar: ¿podía un campo magnético crear una corriente eléctrica?
En 1830, unos diez años después del experimento de Oersted, Joseph Henry, en América, y un año más tarde Michael Faraday, en Londres, descubrieron que un campo magnético podía, en efecto, inducir una corriente, si bien sólo momentánea, si el campo magnético se mantenía en movimiento. Esta proposición puede ser demostrada moviendo un imán en las proximidades de una bobina de alambre, con lo cual se induce una breve corriente eléctrica que fluye por la bobina. Cuando se detiene el movimiento del imán, no se percibe corriente alguna por la bobina.
El descubrimiento de la «inducción electromagnética», creación de una corriente eléctrica por un campo magnético constantemente variable, estaba destinado a ser una de las observaciones más provechosas de todo el estudio de la electricidad. Una vez perfectamente comprendido este principio, resultó evidente que la pila no era la única fuente, ni siquiera la fuente más conveniente, de electricidad; el generador se iba a convertir en una de las mayores máquinas para la producción de fuerza.
Fuerza a partir de bobinas giratorias
En un generador eléctrico se utiliza la energía mecánica, de la fuerza del agua o del calor de una máquina de vapor, para hacer girar una bobina de alambre en el interior de un campo magnético. A medida que gira la bobina se van generando pulsaciones de energía eléctrica de la misma manera que en los primitivos experimentos de Henry y Faraday.
Por otra parte, un motor eléctrico no es más que un generador a la inversa. La corriente del generador crea un campo magnético en una bobina de alambre llamada armadura; la armadura gira al ser alternativamente atraída y repelida por otros imanes que la rodean. Conectado al extremo de la armadura, se encuentra un eje que suministra la energía mecánica que el motor ha producido partiendo de la electricidad.
El motor eléctrico es uno de los más eficientes de todos los convertidores de energía, pues transforma en trabajo más del 90 % de la energía que recibe. En cambio, la máquina de vapor es sólo un 30% eficiente, y la máquina de gasolina, un 50 por ciento.
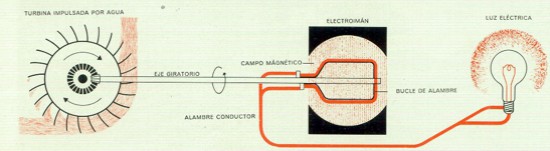
CÓMO ENCENDER UNA LÁMPARA. Una de las principales aplicaciones de la inducción electromagnética es en los generadores, los cuales convierten energía mecánica en energía eléctrica. La energía cinética de la caída de agua y gracias a una turbina y un eje, hace girar un alambre rectangular en un campo magnético. Esto origina un flujo constante de corriente en el alambre, que es conducido hasta una bombilla. Los generadores comerciales utilizan una bobina.
Ningún estudio de la electricidad, por breve que sea, puede dejar de rendir tributo a James Clerk Maxwell, el gran físico inglés de mediados del siglo XIX, ya citado en anteriores capítulos de esta obra por sus trabajos sobre termodinámica, y sus estudios de vanguardia sobre la naturaleza de la luz. Pero Maxwell es quizá principalmente conocido por su contribución a la electricidad. Partiendo del descubrimiento de Faraday de que la corriente eléctrica y el magnetismo están relacionados entre sí, procedió a unificar todos los fenómenos eléctricos, conocidos en su día, en cuatro ecuaciones. El trabajo de Coulomb, Ampère, Oersted, Ohm, Henry y Faraday, entre otros, quedó elegantemente unido gracias a sus matemáticas.
Las ecuaciones de Maxwell fueron uno de los brillantes logros de la ciencia de la era victoriana. Es comprensible que los físicos que siguieron a Maxwell considerasen su palabra como ley. No obstante, podía equivocarse; según el capítulo siguiente mostrará, muchos de los mayores adelantos científicos de nuestros tiempos se han producido porque Maxwell estaba verdaderamente equivocado en una hipótesis fundamental.

LA RÚBRICA DE LA ELECTRICIDAD. El crepitante velo de electricidad de la fotografía está formado por arcos de alta tensión que saltan de un aislador a otro. Cada descarga de 60.000 voltios deja un rastro resplandeciente y calienta el aire, creando corrientes de convección que separan los rastros de los aisladores. Cado rastro eléctrico resplandece una fracción de segundo, lo suficiente para dejar un encaje deslumbrador.
El milagro del relámpago domado
«Llamamos electricidad a aquel fuego de la negra tronada, decía Thomas Carlyle en 1841. Pero ¿qué es? ¿Qué la hizo? ¿De dónde viene?» Estas preguntas nunca han sido completamente contestadas: la verdadera naturaleza de la electricidad no es aún comprendida. Pero estamos bastante seguros de que los fenómenos eléctricos se encuentran en el verdadero centro de la vida, que el átomo mismo es una entidad eléctrica. En todo caso, en los últimos cien años, la electricidad ha irrumpido en la vida diaria del hombre, produciendo cambios tan profundos como los inducidos por la máquina de vapor.
LA RÚBRICA DEL MAGNETISMO. Si se espolvorean sobre un papel limaduras de hierro, éstos se disponen en tal forma que revelan las «líneas de fuerza» que van de un extremo al otro de la barra magnética. Líneas semejantes emanan también de la llave de hierro magnetizada por su proximidad a la barra. Las densidades variables de los grupos de líneas muestran la fuerza del campo magnético.
Pues en su insaciable búsqueda de energía el hombre ha encontrado que la electricidad no tiene rival. Es limpia, cómoda, convertible; sus generadores, imanes, tubos y motores hacen posible la inimaginable riqueza de la civilización. Benjamín Franklin dijo hace cerca de dos siglos: «El fluido eléctrico... puede... ser útil a la humanidad».
Antiguos misterios del magnetismo
La misteriosa fuerza de un frío trozo de metal, que le permite proyectarse a través del espacio y atraer o repeler otros trozos de metal, ha intrigado desde hace siglos. Los antiguos griegos conocían ya los imanes bajo la forma de un mineral de hierro llamado piedra imán, y más tarde fueron utilizados por los chinos para la confección de las primeras brújulas marineras. La tierra misma, al comportarse como un enorme imán, hace tales brújulas posibles.
Los científicos saben que una sustancia magnetizada se compone de átomos, alineados de forma que ejercen su fuerza al mismo tiempo. Todos los imanes, incluso la tierra, tienen dos polos opuestos, llamados norte y sur.
Las extrañas líneas de fuerza que se curvan de polo a polo (ver ambas fotografías) están inseparablemente unidas a fuerzas eléctricas. En efecto, los imanes más potentes no son los llamados "permanentes" aquí representados, sino los "electroimanes" que funcionan por la electricidad. A pesar de todos los conocimientos, la causa del magnetismo continúa siendo un misterio.

RESPLANDECIENTE ARCO DE FUERZA. Un tubo especial construido para producir electrones muestra a un estudiante las líneas de fuerza simétricas que se doblan entre los polos de un imán permanente de herradura. Corrientes de electrones, atraídas por el imán, salen del núcleo del tubo, se precipitan a lo largo de aquellas líneas y al chocar con las moléculas del gas forman media luna de luz.
Electricidad estática: sacudidas fantasmales y molestas
Marineros de tiempos pasados veían asustados a veces por la noche, fantasmas espectrales de luz azulada que bailaban sobre los mástiles de sus naves. A ese efecto le llamaron el fuego de San Telmo, santo patrón de los marineros, pero ahora se ha convertido también en el indeseable compañero de los aviadores. No es en realidad fuego alguno, sino una de las formas de la electricidad llamada estática porque permanece estacionaria sobre la superficie de un objeto, a diferencia de la corriente eléctrica que fluye por un alambre. En el centro de ambas está el electrón, de carga negativa.
PLUMAS DE FUEGO. La moqueta de aeroplano de arriba ha sido cargada con electricidad estática, para que los investigadores puedan estudiar los efectos del fuego de Son Telmo que surge de las esquinas pronunciados, como los extremos de las olas y de lo cola. Los pilotos lo' ven con frecuencia cuando vuelan a través de nieve o cristales de hielo secos, o en las cercanías de tempestades.
El choque que se recibe al pasar sobre una alfombra de lana en días frescos y secos, procede de una carga de electricidad estática, carga formada por electrones que pasan de la alfombra a la suela de nuestros zapatos.
Los átomos de la alfombra, con su deficiencia de electrones, quedan positivamente cargados, mientras que los del zapato están cargados negativamente. Una chispa formada por estos electrones en exceso salta entonces de nuestros dedos a un objeto conectado a tierra con menor carga.
 | ASCENSIÓN ELECTRIFICADA. Las ligeras pelotas de ping-pong suspendidas de unos hilos, a la izquierda, están en equilibrio alrededor del globo metálico cargado de un generador electrostático de juguete. Fueron primeramente atraídas hasta tocar el globo, adquiriendo su misma carga, y fueron luego repelidas por él. Al mismo tiempo se repelen mutuamente y así permanecen en equilibrio. |
Además, cualquier objeto así cargado tiende a atraer otro objeto con carga opuesta, y a repeler otro de carga semejante.
SENSACIÓN QUE PONE LOS PELOS DE PUNTA. La muchacha de la derecha, aislada del suelo, de pie sobre un taburete, está tocando el globo de un potente generador de electricidad estática. Recibe una carga de hasta un millón de voltios y lo único que siente es una picazón y un nuevo peinado. Como todos los cabellos tienen la misma potente carga eléctrica, se repelen mutuamente y se ponen de punta. |
|
Además de proporcionar choques, molestando a marineros y pilotos, la electricidad estática puede también ocasionar perturbaciones. En 1937, determinó la trágica explosión del dirigible Hindenburg, que estaba lleno de hidrógeno, cuando atracaba en Lakehurst, Nueva Jersey.
Motores gigantes y más pequeños que un grano de arena
En pocas palabras; un motor eléctrico es una máquina para convertir energía eléctrica en energía mecánica, utilizando la íntima relación entre electricidad y magnetismo. Si se arrolla un alambre alrededor de una barra de hierro, y se hace pasar una corriente por el alambre, la barra se convierte en un imán. Cuando se hace girar un imán de esta clase sobre un eje, se le llama rotor, y es el corazón de todos los motores eléctricos. Puede llegar a pesar 130.000 kilogramos, o puede ser parte del motor más pequeño del mundo. El rotor produce energía mecánica al girar constantemente entre dos "imanes de campo" fijos. Polos idénticos se repelen, de modo que si el polo sur del rotor se enfrenta con el polo sur del imán de campo, resulta impulsado 180° hacia el polo norte fijo.
| UN ROTOR TAN PEQUERO QUE NO SE VE. El motor más pequeño del mundo, pesa 0,000227 gramos, aparece aquí junto a la cabeza de un alfiler. Fue construido por William McLellan, de Pasadena, California, quien utilizó un palillo de dientes, un microscopio y un torno de relojero. Tiene 0,04 cm de lado y genera uno millonésima de caballo de fuerza. Tiene que observarse con un microscopio. |
Pero tan pronto como el polo sur del rotor llega allá, un aparato llamado "conmutador" invierte la dirección de la corriente en la bobina; eso invierte los polos del rotor, de modo que el polo norte fijo comunica al rotor otro impulso de 180°, haciéndole completar su giro. Este cambio continuo de corriente hace que el rotor vaya girando indefinidamente, y es posible aprovechar su rotación con objeto de producir trabajo útil.

UN ROTOR QUE NO SE PUEDE TRANSPORTAR. Aquí se está haciendo bajar un rotor de 169 toneladas, muy ajustado, al interior de uno de los motores más grandes del mundo en el embalse Grand Coulee del río Columbia. Capaz de generar 65.000 caballos de fuerza este imán gigantesco hubo de ser construido en el mismo embalse, pues ningún tren ni camión hubiese podido llevar tan enorme peso.
Receta para construir en casa un sencillo motor
Si bien el gigantesco motor representado en la página anterior es sin duda una máquina compleja y costosa, se puede construir fácilmente un motor primitivo con solamente las herramientas y materiales que presentamos en la fotografía inferior. Los ingredientes fundamentales son:
- ocho chinchetas,
- tres sujetapapeles de cinco centímetros,
- dos clavos de ocho centímetros,
- alicates de puntas finas,
- cinta aislante,
- dos pilas secas de un voltio y medio,
- un tablero de madera de doce por quince centímetros,
- un pequeño carrete de alambre de cobre aislado de #20, y
- un cuchillo para rascarlo.
|
|
La mayor parte de estos artículos se pueden encontrar en casa, pero aunque hubiese que comprarlo todo, el costo total no debería exceder de cuatro dólares; estas páginas y las siguientes indican, en 15 fases ilustradas, el modo de montarlo.
El primer paso para hacer un motor consiste en tomar uno de los sujetapapeles y enderezar su horquilla más pequeña y luego doblarla de manera que quede derecho en ángulo recto. Se usan los alicates para formar un anillo en el extremo vertical. |
|
A continuación se fija el sujetapapeles al tablero con dos chinchetas, según la foto. El sujetapapeles debe colocarse cerca del centro del tablero y paralelo al lado más largo de éste. Luego se prepara otro sujetapapeles igual que en la fase 1. |
|
Se fija luego el segundo sujetapapeles a dos centímetros y medio del primero. Es importante dejar las chinchetas lo suficientemente sueltas para que los sujetapapeles puedan moverse libremente; éstos forman los soportes para el eje rotor del motor. |
|
Luego se hace el rotor. Con los alicates se doblan los extremos del tercer sujetapapeles de modo que queden perpendiculares a su posición anterior, según la foto. Cada uno de dichos extremos deberá medir un centímetro y cuarto. |
|
Dejando dos centímetros y medio libres, arróllese apretadamente el alambre de cobre alrededor del sujetapapeles del rotor, comenzando por el centro. Hágase el arrollamiento bien apretado, pero es importante que no se deforme el sujetapapeles |
|
Dénse unas 20 vueltas hacia el extremo del sujetapapeles rotor, llévese luego el alambre nuevamente al centro y arróllese en la misma dirección, un número igual de vueltos. Estos arrollamientos convertirán el sujetapapeles en un electroimán. |
|
Una vez se ha terminado de arrollar el alambre de cobre alrededor de la segunda mitad del sujetapapeles rotor, según la foto, se le vuelve al centro de éste, como en la fase 6. Los extremos del alambre servirán como conmutador del rotor. |
|
La fase siguiente consiste en cortar los extremos del alambre de modo que queden algo más cortos que los extremos proyectantes del sujetapapeles. Se rasca la punta .de los .alambres, descubriendo el cobre; ambos extremos estarán en igual dirección. |
|
Tómese dos tiritas de cinta aislante o adhesiva, de medio centímetro de ancho y cinco centímetros de largo cada una, y arróllese una a cada extremo del eje, o extremos proyectantes, del sujetapapeles rotor. La cinta mantiene el eje en el soporte. |
|
Para hacer los dos imanes fijos, envuélvanse con alambre cada uno de los clavos, dejando 25 cm de alambre libre cerca de la cabeza. Arróllese el alambre unos 6 cm de la cabeza hacia abajo, y luego hacia arriba, la mitad de esa distancia |
|
Déjense unos quince centímetros de alambre que salgan del centro de cada uno de los clavos, y córtese. Cada uno de los clavos debe ahora tener una cola de 15 cm y otra de 25. Clávense los clavos separados 4,5 cm, según indica la fase 12. |
|
Sujétese al tablero la cola de quince centímetros de un clavo, y llévese a 0,5 cm de uno de los soportes doblándola de manera que su extremo quede más alto que el soporte. Hágase igual con un alambre de 30 cm; éstos forman las escobillas. |
|
Después de rascar dos centímetros de aislador de los de los dos alambres verticales (escobillas), encájese el eje del rotor en las anillas de cada soporte de manera que los conmutadores del rotor, al girar, hagan contacto con las escobillas. |
|
Retuérzase el extremo de la cola de quince centímetros del segundo clavo alrededor del alambre de 25 cm del primer clavo. (Rásquense para conseguir contacto.) El alambre de 25 cm del segundo clavo se conectará con una de las baterías. |
|
Sujétese el alambre del segundo clavo al terminal central de una pila. Únase el extremo libre del alambre de treinta centímetros al terminal lateral de la otra pila. Un corto alambre que conecta los restantes terminales completará el circuito. |
|
| EL MOTOR TERMINADO. Puede ser necesario dar un pequeño empujón al rotor. Mientras gira el rotor, ambos conmutadores deben tocar simultáneamente ambas escobillas, de modo que los sujetapapeles tienen que doblarse para colocar en posición el rotor |
Capítulo 7
El mundo fantástico del doctor Einstein
LA FE DE UN FÍSICO. En 1905 Albert Einstein renovó el concepto clásico del universo en dos breves publicaciones. Desde entonces fue el deseo de su vida englobar todas las fuerzas de la naturaleza en un conjunto unificado de ecuaciones. Se mantuvo firme en su fe de que era el orden y no el caos, lo que gobernaba el cosmos. Decía: «Dios no juega a los dados con el universo.»
«Lo más incomprensible del mundo, dijo una vez Einstein, es que es comprensible.» No obstante, nadie había hecho tan difícil para el hombre de la calle la comprensión de su mundo. El tiempo se dilata, el espacio se contrae, la sustancia del mundo estalla y desaparece. El mundo real tiende a convertirse en el mundo del matemático. Tal es el curso de la ciencia y de la idea que el hombre se hace de la energía, desde 1905, fecha de la primera publicación científica importante de Einstein, hasta la fecha.
Esta aventura en un nuevo y abstruso mundo comienza con la demolición de un concepto popular en el siglo XIX promulgado por Clerk Maxwell en su teoría electromagnética de la energía radiante. «Tenemos, por lo tanto, cierta razón para creer, partiendo de los fenómenos de la luz y del calor, escribió en 1865, que existe un medio etéreo que llena el espacio y penetra en los cuerpos, capaz de movimiento y de transmitir ese movimiento de una parte a otra, y de comunicarlo a la materia bruta, calentándola y afectándola de diversas maneras.»
Esta palabra arcaica, «éter», tenía para Maxwell un significado preciso; al explicar su teoría electromagnética había postulado su existencia para ayudar la representación mental de la forma en que la luz se transmite a través del espacio. En su definición, el éter era el medio a través del cual se transmitía la energía radiante y a través del cual vibraban las ondas electromagnéticas. Algunos de sus colegas del siglo XIX llegaron a usar la expresión «viento de éter», como si hablasen de una brisa que sopla a través de un bosque; y como se suponía que este medio impregnaba todo el universo, se creía también que la misma tierra se desplazaba a través del «éter» mientras giraba sobre sí misma y alrededor del sol.
Al tiempo de la muerte de Maxwell en 1879, la necesidad de confirmar la existencia del éter se había convertido para muchos hombres de ciencia en algo obsesionante. Fuese lo que fuese, se trataba de una sustancia muy variable. Por un lado, un medio tan universal y tan invisible tenía que ser lo suficientemente tenue para permitir que los cuerpos celestes circulasen libremente a su través; por otro, su elasticidad debería ser superior a la del acero para soportar las vibraciones de las ondas de la luz y de la radio.
Maxwell había sugerido que la presencia del éter quedaría demostrada si se podía probar que disminuía la velocidad de la luz. Pero esa medida es dificilísima, porque la luz se mueve con tal rapidez que un avión a la misma velocidad daría en un segundo unas siete vueltas y media a la tierra por el ecuador. El tiempo que transcurre mientras la luz pasa de una pared a otra del laboratorio es tan infinitesimal que es prácticamente inconmensurable. Y la cantidad que había que medir en el problema de Maxwell era aún más pequeña: había propuesto establecer la diferencia entre el tiempo empleado por la luz en ir de un punto a otro, y el tiempo que tardaría en el viaje de regreso. Era evidente que tal experimento no podía ser llevado a cabo utilizando aparatos de medida ordinarios.
EL VIENTO DE ÉTER: UN FANTASMA MISTERIOSO
EL MEDIO INVISIBLE. Los científicos del siglo XIX creían que las ondas luminosas eran transmitidas por un medio invisible, el «éter», y que el movimiento de la tierra a su través creaba un «viento de éter». Suponían que la luz era afectada por este viento lo mismo que una barca por una corriente de agua, y que se movía más rápidamente a favor del viento.
En 1887, los americanos Albert Michelson y Edward Morley intentaron demostrar su existencia.
No obstante, si se pudiera encontrar la manera de probar que realmente existe una diferencia en el tiempo transcurrido, cualquiera que fuese la proporción, eso sería suficiente prueba de la existencia del éter. Este aspecto del problema fue abordado en 1887 por dos científicos americanos, Albert A. Michelson y Edward W. Morley, quienes utilizaron un ingenioso aparato, llamado interferómetro.
Olas, ondas y ondulaciones
El efecto que causa una piedra al caer al agua, es semejante al fenómeno de interferencia que se observa en la luz. Cada piedra inicia un conjunto de pequeñas ondas en círculos cada vez mayores, y eventualmente las ondas procedentes de diversas piedras tienen que entrar en contacto. Cuando una se encuentra con la otra en su parte superior, la ondulación del agua se acentúa, pero cuando una cima se encuentra con un seno, la ola se aplana. Del mismo modo, si dos ondas de luz idénticas se mueven simultáneamente a la misma velocidad sobre distancias iguales, están en fase, o al mismo paso, cuando llegan a su común destino. Una cima encuentra a la otra y las dos ondas combinan sus fuerzas; pero si estas ondas se mueven a diferentes velocidades, o sobre distancias diferentes, lo más probable es que al llegar a su destino estén fuera de fase y tiendan, por lo tanto, a anularse mutuamente. El resultado acostumbra a ser una imagen alternante de brillo y oscuridad llamada «bandas de interferencia».
Michelson y Morley sugirieron que si el espacio estuviera lleno de éter, un haz de luz proyectado en la dirección del movimiento de la tierra debe ser retardado de la misma manera que un barco es retardado cuando navega contra una corriente. Para ensayar su idea imaginaron lo que se considera uno de los experimentos más elegantes en la historia física. Su aparato tenía en el centro un espejo que podía dividir un haz de luz y enviar cada mitad del haz en dirección diferente. Dos espejos más, dispuestos a una distancia muy cuidadosamente medida del primero, enviaban los haces divididos a un ocular donde se recombinaban. El aparato podía ajustarse de tal modo que la mitad del haz podía enviarse en la dirección del movimiento de la tierra, y la otra mitad en otra dirección.
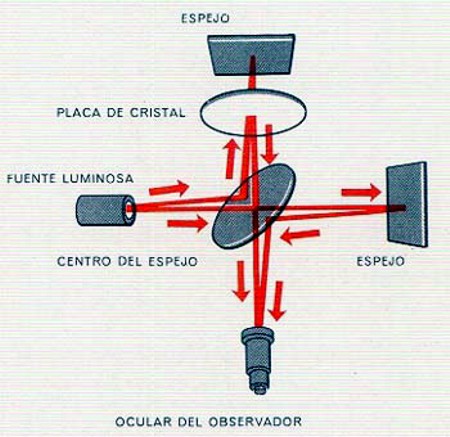
PARA NO DEJAR ENTRAR EL VIENTO DE ÉTER. Para demostrar lo existencia del éter, Michelson y Morley idearon un interferómetro, que dividía un haz de luz y lo enviaba en dos direcciones al mismo tiempo. Parte pasaba o través del espejo central levemente plateado y parte era reflejado a través de una placa de cristal transparente que compensaba el efecto retardador del espejo sobre el otro haz, Después de rebotar sobre las espejos externos, los haces se reunían en el centro. Si el viento de éter hubiese afectado la velocidad de la luz, los haces hubiesen estado fuera de fase al regresar. Pero no lo estaban. Así comenzó el descrédito de la teoría del éter.
El razonamiento en que se basaba este experimento era el siguiente: si la luz que estaba orientada en la dirección del movimiento de la tierra era retardada por su paso a través del éter, debería estar fuera de fase con la otra mitad del haz, cuando se recombinasen. Al llevarse a cabo el experimento no se halló que los haces estuviesen fuera de fase. Tales experimentos fueron repetidos año tras año en diferentes lugares y por diferentes científicos, pero los resultados fueron siempre negativos.
El experimento de Michelson-Morley constituyó un serio golpe para la teoría del éter, pero en 1893 G. F. Fitzgerald, del Trinity College de Dublín, y H. A. Lorentz, de la Universidad de Leyden, propusieron independientemente soluciones casi idénticas para salvar la teoría del éter. Fitzgerald y Lorentz postularon que un objeto que se mueve a través del éter, se encoge en la dirección de su movimiento en una proporción que depende de lo que su velocidad se aproxime a la de la luz. La «contracción de Lorentz-Fitzgerald», así se la designó, recibió una expresión matemática sencilla. En esas ecuaciones la velocidad de la tierra alrededor del sol requería una contracción del aparato de Michelson y Morley de una doscientos millonésima parte. Con ser tan pequeña, esta modificación era suficiente para explicar el aparente fracaso del experimento. La contracción del aparato, su encogimiento físico real, hubiesen ocultado cualquier disminución en la velocidad del haz que había sido retardado por su paso a través del éter.
Ni Lorentz ni Fitzgerald consiguieron interpretar esta contracción; sus hipótesis eran puramente matemáticas y de momento parecían ofrecer respuestas adecuadas. Pero la idea de que la materia sólida pudiera contraerse en virtud de su movimiento atrajo la atención popular, hasta el punto de que en su día un epigrama satirizó la teoría:
Una vez un joven llamado Frisko
Tiraba a esgrima con gran rapidez;
Tan rápida fue su acción
Que de Fitzgerald la contracción
Redujo su florete a un disco.
Si bien Lorentz y Fitzgerald habían, al parecer, salvado la teoría del éter, lo hicieron a expensas de haber creado un problema peor del que habían resuelto. ¿Cómo podía el movimiento hacer que se encogiese un objeto? La respuesta la proporcionó Albert Einstein, quien en una ocasión explicó la razón de su afición a las ciencias naturales de esta manera:
«Allá afuera, escribió, estaba este gran mundo que existe independientemente de nosotros, seres humanos, y que se nos presenta como un grande y eterno enigma... La contemplación de este mundo me llamaba como una liberación...»
El misterio de una brújula de bolsillo
La vocación por la investigación científica había impulsado a Einstein a considerar los misterios de una brújula de bolsillo, incluso antes de comenzar sus estudios en la escuela de Munich, y pronto se encontró sumergido en el mundo que acababa de descubrir. A los 16 años, cuando solicitó su admisión en el Instituto Politécnico Federal Suizo de Zurich, fue rechazado por su inadecuada formación en lenguas modernas, zoología y botánica. No obstante, un año más tarde fue admitido.
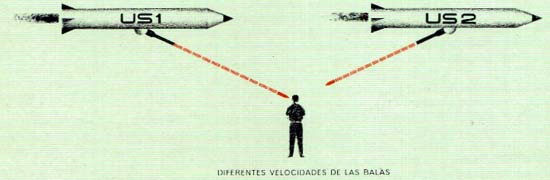
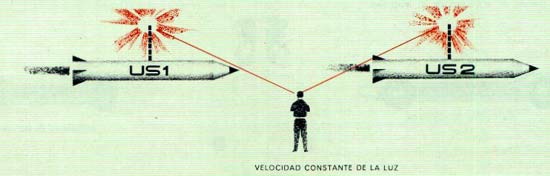
SORPRENDENTE CONSTANCIA DE LA LUZ. Si desde dos cohetes equidistantes del observador, que se mueven a la misma velocidad se disparan simultáneamente unas balas, la bala del cohete que se acerca dará en el blanco antes (arriba). Su velocidad estará aumentada por la velocidad del cohete, mientras que la segunda bala estará retardada. Si desde los cohetes se hiciesen señales luminosos simultáneos, ambos haces llegarían al mismo tiempo, ejemplo del postulado de Einstein, que afirma que, cualquiera que seo el movimiento de su fuente de origen, la luz se mueve en el espacio a la mismo velocidad (abajo).
En el Instituto, donde comenzó los estudios que tenían que contribuir a formar su pensamiento, Einstein conoció al gran matemático Hermann Minkowski (quien más tarde diría, en su lecho de muerte: «¡Qué pena morir en la víspera de la Relatividad!»). Como teórico, Minkowski concibió una importante contribución a la Teoría especial de la Relatividad, pero tenía poco talento como maestro. No obstante, según el biógrafo de Einstein, «...fue Minkowski, cuyas conferencias matemáticas Einstein encontraba tan poco interesantes, quien expresó ideas para una formulación matemática de las teorías de Einstein, que formaron el germen de todos los progresos futuros en aquel campo».
Un prodigio en una oficina de patentes
Después de haberse graduado en el Instituto, Einstein encontró trabajo como empleado en la oficina de patentes suiza de Berna. Allí, en la necesidad de comprender rápidamente los conceptos básicos de las invenciones que se presentaban para ser patentadas, desarrolló su extraordinaria facultad para asimilar la consecuencia teórica principal de los experimentos científicos. Además, sus obligaciones en la oficina de patentes desarrollaron su inclinación por la construcción de aparatos científicos, recuerdo de la cual aún existe en Berna, en forma de un aparato que ideó para medir pequeñas cargas eléctricas. «Tal trabajo, escribió uno de sus biógrafos, era para él una especie de distracción de sus investigaciones teóricas abstractas, de la misma manera que el ajedrez y las historias de detectives sirven para distraer a los científicos.» Su entusiasmo por las invenciones era tal que, después de haber dejado la oficina de patentes, numerosas industrias de Europa le encargaban el estudio de nuevos aparatos.
De este breve período en Suiza proceden cierto número de publicaciones transcendentales, escritas sobre varios asuntos científicos, cada uno de los cuales hubiese creado por sí mismo una revolución en física. Una de sus publicaciones: «Sobre los cuerpos electrodinámicos en movimiento», publicada en 1905, cuando solamente tenía 26 años, contenía las ideas esenciales de la Teoría especial de la Relatividad de Einstein. Sus conclusiones iban directamente a la esencia de la mecánica clásica y del electromagnetismo. Primero, Einstein rechazó la teoría del éter. Segundo, afirmó que no existía el espacio fijo, es decir, un espacio tal en que pudiera distinguirse entre movimiento relativo y movimiento absoluto. En otras palabras, no existe nada en el universo que podamos estar seguros de que está fijo. Cualquiera que haya estado sentado en un tren parado mientras otro tren pasa junto a la ventanilla, lo ha podido observar. De repente resulta imposible decir cuál de los dos trenes es el que se mueve. Finalmente, y quizás lo más importante, está su conclusión de que la luz siempre tiene la misma velocidad de cualquier manera que se la mida. Einstein consideró que la velocidad de la luz es una constante universal.
Partiendo de estos postulados, Einstein afirmó que cada observador tiene que practicar sus propias medidas en su propio sistema de referencia, su casa, su planeta o su galaxia. Desde todos los puntos de vista prácticos, todas las cosas se mueven por el espacio a diversas velocidades. No existe ni éter ni poste indicador fijo en el universo que permita localizarse a uno mismo, o medir su velocidad. Lo único en común es que todo el mundo, en todas partes, sea cual fuere su estado de movimiento, obtendrá la misma respuesta si intenta medir la velocidad de la luz.
La idea de Einstein tiene consecuencias interesantes. Supongamos que ha sido puesta en órbita sobre la tierra una plataforma espacial, llevando a bordo un científico para que compruebe la velocidad de la luz con una regla y un reloj. Aunque sea sorprendente, estos dos instrumentos es todo lo que necesita para la operación, puesto que la velocidad es sencillamente la medida de hasta donde algo llegará en un tiempo dado. El científico efectúa sus medidas y encuentra que la luz se mueve a 300.000 kilómetros por segundo, lo mismo que cuando mide la velocidad sobre la tierra.
Se envía luego desde la tierra una segunda expedición para efectuar exactamente la misma medida; pero este segundo científico no goza de las comodidades de una estación espacial relativamente lenta. Se le indica que efectúe sus mediciones desde una nave cohete en rápido movimiento, utilizando una regla y un reloj que, comparados sobre la tierra, eran absolutamente idénticos a los situados a bordo de la estación espacial. Cuando el cohete pasa junto a la estación espacial, el científico toma sus medidas mientras el científico en la estación espacial observa a través del telescopio.
Este último hombre observa que la nave cohete, su colega y la regla que utiliza, han disminuido de tamaño en la dirección en que se mueven. Pero, más desconcertante aún, oye la información de la nave cohete sobre la velocidad de la luz. Según su colega, la luz se mueve a exactamente 300.000 kilómetros por segundo. ¿Cómo puede ser eso? La utilización de una regla más corta para las medidas debió haber producido un resultado diferente. La conclusión es que la otra variable en el cálculo de la velocidad ha variado también: que el tiempo se ha «retardado».
Viaje en tiempo lento
Esta retardación del reloj en la nave cohete es un ejemplo de lo que los físicos llaman dilatación del tiempo. Se halla predicha en las ecuaciones de Einstein y es el resultado natural de la velocidad constante de la luz. A primera vista esto puede parecer ser solamente un brillante ejercicio mental, una especie de idea matemática inútil, sin aplicación en el mundo real. No obstante, Einstein siempre percibió que era algo más que una gimnasia mental; creía que la dilatación del tiempo era una propiedad auténtica del mundo real. Einstein insistía en que un hombre que se alejaba de la tierra en una nave cohete experimentaría la retardación de su reloj.
Además, el hombre de tal viaje podría regresar a la tierra y encontrar que todo lo que estimaba, su familia, su país, su civilización, habían desaparecido por completo. Un viaje a una estrella próxima a una velocidad próxima a la de la luz podría parecerle a él de solamente unos cuantos años, y en verdad solamente envejecería biológicamente unos cuantos años, pero al regresar a la tierra podría encontrar que habían transcurrido siglos de tiempo terrestre, alterando todo lo que conociera.
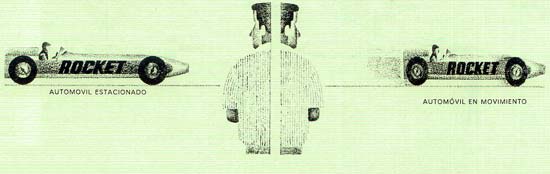
EXTRAÑOS CAMBIOS DE LONGITUD. Si bien el conductor no se da cuenta, el automóvil que representamos aquí arriba es más corto cuando va a gran velocidad que cuando está inmóvil, según la teoría de la relatividad de Einstein. Aquí se ha exagerado el efecto; en realidad lo contracción del automóvil más veloz sería imperceptible para el observador. Incluso a 30.000 kilómetros por hora, una nave cohete en el espacio se encogería solamente 0,0000000003 por ciento. Pero si un astronauta llegase a alcanzar el 90 % de la velocidad de la luz, él y su nave se contraerían algo menos de la mitad de su longitud.
A semejanza de la teoría de la contracción de Lorentz y Fitzgerald, este asalto de Einstein al sentido común inspiró la pluma de un escritor de epigramas que llevó la dilatación del tiempo a sus últimas consecuencias en el siguiente poema:
Una vez una dama llamada María
Corría más veloz que la luz;
Salió de su casa un día,
De manera relativa,
Y volvió la noche anterior.
La teoría de la dilatación del tiempo no tuvo comprobación durante los 31 años siguientes a haber sido propuesta por Einstein. Pero a partir de entonces los científicos comenzaron a observar, a nivel subatómico, ejemplos físicos reales de esta retardación. Se presenta, por ejemplo, en la desintegración de ciertas partículas subatómicas llamadas mesones, de masa intermedia entre el electrón y el protón. En condiciones ordinarias estos mesones son de vida cortísima y se transforman espontáneamente en otras dos partículas, un electrón y un neutrino. Pero a velocidades muy elevadas, próximas a la de la luz, se ha observado una demora apreciable antes de ocurrir su desintegración espontánea.
Otra vez frente a lo establecido
Además del extraño comportamiento del tiempo y de la luz predicho por sus ecuaciones, la teoría de Einstein sugirió una nueva y muy inesperada posibilidad de la transformación de la energía. En su tiempo los físicos habían aceptado ya, no solamente el principio de la conservación de la energía, sino también otro principio llamado de conservación de la masa, que sencillamente afirmaba que la masa no puede ser ni creada ni destruida.
Cualquier variación de una masa determinada solamente podía proceder de aumento o disminución mecánica o química. En otras palabras, una cantidad determinada de masa podía ser aumentada encolando, clavando o fundiendo sobre ella más masa, o bien podía ser vaporizada, disuelta y partida para hacerla más pequeña. Pero se consideraba que la suma total de masa del universo permanecía para siempre constante. Hasta Einstein, los físicos hubiesen dicho que el movimiento de la materia no podía modificar su naturaleza fundamental; pero esta idea resultó estar en completa contradicción con los resultados de Einstein.
Los científicos no siempre calculan la materia pesándola en unas balanzas, sino que con más frecuencia la definen según la velocidad que adquiere cuando una fuerza conocida la empuja o tira de ella. El resultado de tal medida no se llama peso, sino masa. Dado el mismo impulso, una masa grande cobrará velocidad mucho más lentamente que una masa más pequeña. Los científicos no tenían razón para dudar que, si se daba un empujón lo suficientemente fuerte, un trozo de materia podía ser acelerado hasta que su velocidad fuese mayor que la de la luz.
Ahí es donde Einstein dijo que no. Nada, afirmó, podía ir más rápidamente que la luz. La velocidad afectaba, no solamente la luz y el tiempo, sino también la masa. A medida que un cuerpo se aproximaba a la velocidad de la luz, su masa aumentaba, y sería cada vez más difícil empujarlo. A la velocidad de la luz su masa sería infinita, y ninguna cantidad de energía podría acelerarlo, hecho actualmente comprobado por observaciones reales.
A velocidades corrientes el aumento de masa predicho por la relatividad es imperceptible. Incluso un avión a chorro a la velocidad del sonido aumentaría su masa en solamente una diez mil millonésima de un uno por ciento. Pero la masa aumenta rápidamente al aproximarse a la velocidad de la luz; a un 90 % de esa velocidad, la masa ha aumentado más del doble. Este efecto es muy importante en el diseño de algunos de los mayores rompedores de átomos. En estas máquinas se hacen girar repetidamente en un círculo las partículas atómicas, aumentando un poco de velocidad y de masa a cada revolución. Es, por lo tanto, necesario ajustar a cada ciclo las fuerzas eléctricas que empujan las partículas, a fin de mantener en movimiento las partículas, que son cada vez algo más pesadas.
Hasta aquel punto Einstein había solamente afirmado que la masa y el movimiento de la materia (energía cinética) estaban relacionados entre sí. Después de relacionarlos en este sentido restringido, dio el gran paso hacia adelante que eventualmente debería conducir a la era atómica. La masa, afirmó, es equivalente a la energía en todas sus manifestaciones. Así pues, la energía y la materia no son las dos caras del universo, sino sencillamente dos lados de la misma cara. Aumentos y disminuciones de energía, según esta teoría, van siempre asociados a una variación de masa. Incluso calentar un objeto aumenta imperceptiblemente su masa.
Riquezas inaccesibles
Estas alteraciones de masa que acompañan los cambios corrientes de energía, calentamiento sobre un hornillo, correr por la carretera, son tan pequeñas que las pesas normales no pueden, en modo alguno, revelar la variación. No obstante, esta relación entre masa y energía sugirió a Einstein que podría ser posible una conversión directa de la masa en alguna forma de energía útil, pero cuando publicó su teoría, la forma de efectuar esta conversión era totalmente desconocida.
![]()
CADA VEZ MÁS DIFÍCIL. El hombrecillo de los dibujos de aquí arriba, además de entendérselas con la bola, tiene que luchar con la Teoría Especial de la Relatividad de Einstein. Cuando más de prisa va la bola, más pesada se hace, puesto que, según la teoría, la masa aumenta con la velocidad. Además, a medida que aumenta la velocidad, la bola se va contrayendo en la dirección del movimiento. Estos efectos han sido exagerados en el dibujo, y sólo son perceptibles a lo velocidad de la luz.
Según la ecuación de Einstein, la ahora famosa E = mc2, la cantidad total de energía (E) encerrada en una masa (m) es igual a m multiplicada por el cuadrado de la velocidad de la luz (c). Lo mismo que en todas las demás ecuaciones que relacionan cantidades físicas, hay que tener cuidado en expresar todos los números en unidades adecuadas. En la ecuación anterior, E es el número de ergios, si se expresa m en gramos y c en centímetros por segundo. Por ejemplo, un gramo de cualquier sustancia, convertido totalmente en energía (tomando para la velocidad de la luz su valor de 30 mil millones de centímetros por segundo), produciría:
E = 1 X 30.000.000.000 x 30.000.000.000 ergios,
o sea 900 trillones de ergios, equivalentes a 25 millones de kilowatios-hora. En forma más gráfica, puede decirse que la masa de un billete de ferrocarril contiene suficiente energía para que un gran tren pueda dar varias veces la vuelta alrededor del mundo. Un kilogramo de materia enteramente convertida en energía sería equivalente a veinte millones de toneladas de TNT.
Durante los años que siguieron a la publicación de la teoría de Einstein, su afirmación de la equivalencia de la masa y de la energía fue objeto de muchas discusiones y especulaciones afanosas. Pues si Einstein tenía razón, las sustancias corrientes que nos rodean encerraban riquezas inimaginables, un nuevo El Dorado, más fabuloso que todos los yacimientos de oro del mundo, con tal de que el hombre pudiese liberar y utilizar esa energía.
Esta idea pareció tan fantástica a los amigos de Einstein en Berna, que se negaron a aceptar su teoría. Una conversación típica ha sido descrita en una reciente biografía por Peter Michelmore:
- Dice usted que hay más caballos de fuerza en un pedazo de carbón que en toda la caballería prusiana, le dijeron lamentándose. Si eso fuese cierto, ¿por qué no se ha observado antes?
- Si un hombre fabulosamente rico nunca gasta un solo céntimo, respondió Einstein, nadie podrá decir cuánto dinero tiene, ni siquiera si tiene algo, o nada. Ocurre lo mismo con la materia; en tanto que algo de esa energía no salga al exterior, no puede ser observada.
- ¿Y cómo se propone usted liberar esta energía oculta?
- No existe ni la más mínima indicación de que esa energía pueda nunca ser obtenida, dijo Einstein. Significaría que podía destruirse el átomo a voluntad... Solamente vemos desintegraciones de átomos cuando la naturaleza las presenta.
En esa misma conversación, según Michelmore, preguntaron a Einstein si había calculado su ecuación de energía a partir de sus experimentos, y sus amigos se quedaron horrorizados cuando les dijo que hacía años que no había entrado en un laboratorio. El trabajo de laboratorio no era necesario:
«La física es un sistema lógico de pensar en fase de evolución. No se puede obtener su base sencillamente con experimentos y experiencia. Su progreso depende de la libre invención... no tengo la más pequeña duda de que tengo razón».
A pesar de sus críticos, la teoría fue poco a poco ganando adeptos, a medida que se iba acumulando evidencia experimental en su favor. La confirmación más sensacional de la equivalencia de masa y energía se presentó en 1932, al descubrirse una nueva partícula fundamental llamada positrón. Apareció en el curso de investigaciones sobre fotones de elevada energía, los cuales habían sido estudiados bajo dos formas: como rayos gamma que emanan de sustancias radiactivas, aquí en la tierra, y como rayos cósmicos que bombardean la tierra desde el espacio exterior. Los fotones de los rayos cósmicos, que revelaron energías mucho mayores que los procedentes de los rayos gamma, habían sido estudiados por vez primera solamente tres años antes por el científico británico C. T. R. Wilson, en un instrumento llamado «cámara de niebla». En este aparato, el paso de una partícula cargada, a través de una neblina de vapor de agua, deja un rastro de pequeñas gotitas que pueden ser fotografiadas. Cuando la cámara de niebla, se sitúa entre los polos de un electroimán, el campo magnético hace que las partículas cargadas se muevan en trayectoria curva a través de la niebla, pudiéndose utilizar la dirección de la curva para calcular la carga eléctrica de las partículas.
En 1932, C. D. Anderson, un físico de la Universidad de California, observó una trayectoria curvada en dirección opuesta a la seguida por electrones de carga negativa ordinarios. La densidad de aquella trayectoria mostraba que la masa de la partícula de aparente mal comportamiento era la de un electrón, pero la curvatura opuesta de la trayectoria indicaba que la partícula estaba positivamente cargada. Anderson denominó esta nueva partícula «positrón».
Había ocurrido lo siguiente: algunos fotones de los rayos cósmicos se estaban transformando de paquetes de energía electromagnética sin masa, en pares de electrones y positrones con masa. Esta conversión de energía en masa estaba absolutamente de acuerdo con la ecuación de Einstein.
Un estudio ulterior del fenómeno de los rayos cósmicos reveló que lo inverso de la destrucción de fotones también ocurre; la masa puede convertirse en energía. Los experimentos demostraron que positrones y electrones libres pueden aniquilarse mutuamente, convirtiéndose su masa en la energía de los fotones. Ahí había nueva evidencia de que la ecuación de Einstein es válida en ambos sentidos de la transformación.
Una pista en las estrellas
Hasta entonces los científicos tenían poca idea de cómo podría efectuarse la conversión de masa en energía con usos prácticos. Por otra parte, era cada vez más evidente que la gran producción de energía de las estrellas, incluso la de nuestro sol, debe tener su origen en alguna forma de transformaciones nucleares semejantes a las observadas en las cámaras de nubes.
En 1938, Hans Bethe, profesor de física de la Universidad de Cornell, ideó una teoría para explicar lo que podían ser esas transformaciones nucleares. Según Bethe, las temperaturas extremadamente elevadas que se encuentran en el sol, y la enorme presión que ejerce su gran masa hacen que los protones se unan en el proceso llamado fusión. En la reacción de fusión, cuatro protones se combinan para formar el núcleo de un átomo de helio. La masa de este núcleo es muy poco menos que la de los cuatro protones; la masa que falta se ha convertido en la energía del sol.
E = mc2
|
Al año siguiente, dos químicos alemanes, Otto Hahn y Fritz Strassmann, realizaron accidentalmente un descubrimiento que debía, por fin, dar al hombre el medio de liberar la energía del átomo. Al bombardear con neutrones una muestra de uranio, con la intención de crear elementos más pesados, pasatiempo favorito en la investigación atómica de aquella época, hallaron con sorpresa que la mezcla resultante contenía bario, sustancia mucho más ligera.
Ese misterio fue resuelto por Lise Meitner y Otto Frisch, entonces refugiados del nazismo, y que trabajaban en Suecia: demostraron que el núcleo del uranio se había dividido en elementos más ligeros, cuyo peso combinado era inferior al del uranio. El uranio que faltaba se había convertido en energía.

CÓMO SE ALIMENTA UN HORNO ATÓMICO. Hay más de 1.203 aperturas para combustible en la cara del reactor más antiguo del mundo en Oak Ridge, Tennessee. Un técnico introduce un lingote de combustible de uranio por medio de una larga varilla, o través de un canal, hasta el núcleo del reactor, mientras que a la izquierda un físico sanitario mide la radiactividad utilizando un contador de Geiger.
Si bien los científicos comprendieron pronto el significado de este descubrimiento, no estaban aún preparados para utilizarlo en la práctica. Hasta entonces, la única forma que tenían de reproducirlo en sus laboratorios era aplicando más energía de la que se liberaba en la reacción misma. Faltaba aún encontrar la manera de hacer que la reacción se mantuviese a sí misma.

PLACA DE BRONCE EN HONOR DE FERMI. La placa de bronce de la izquierda en el Stagg Field de Chicago conmemora la histórica reacción de escisión en cadena. Fermi, criticado en Italia por no hacer el saludo fascista al recibir el Premio Nobel en 1938, no volvió nunca a Italia, y se hizo ciudadano americano en 1945.
Pero la suerte estaba ya echada. En 1945, solamente seis años más tarde, los esfuerzos del Gobierno de los EEUU, inspirados por la guerra, y que dirigían la mayor concentración de inteligencias científicas jamás aplicadas a una sola tarea, habían resuelto el enigma. El hombre había liberado la energía explosiva del núcleo.
De una mota de materia, una fuerza enorme
Cuando el doctor Enrico Fermi puso en marcha la primera reacción nuclear en cadena en 1942, un colega suyo resumió lo que eso significaba en nueve palabras simbólicas: «El navegante italiano ha desembarcado en el nuevo mundo». Ese nuevo mundo era, como es lógico, la era atómica. En 1905 Albert Einstein había previsto en teoría que una pequeña cantidad de materia podía proporcionar una cantidad enorme de energía.
Cuando el equipo de científicos dirigido por Fermi encontró una forma práctica de abrir el corazón de la materia, el núcleo, la teoría de Einstein se convirtió en realidad. Doce años más tarde una sola bomba que estalló en Bikini tenía cinco veces la potencia destructora de todas las bombas convencionales utilizadas en la segunda Guerra Mundial. Ahora la fuerza nuclear está al servicio del hombre. Reactores como el de más abajo producen radioisótopos útiles y también generan electricidad.

LA CUNA DE UNA ERA. El grabado muestra las tribunas, hoy derruidas, del Stagg Field de la Universidad de Chicago, tal como estaban en 1942 cuando, en la pista de «squash», un grupo de científicos inició la era atómica. Brindaron en silencio, bebiendo vino en vasos de papel.
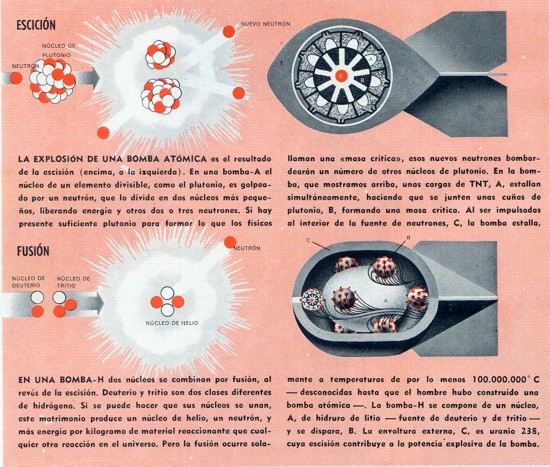
La espantosa locura de la bomba A
Si un átomo fuese del tamaño de una habitación, su núcleo no sería mayor que un grano de arena. Pero cuando se divide un núcleo inestable como el del uranio 235, como en la reacción de escisión de arriba, la energía desprendida por unos pocos kilogramos de ese metal es equivalente a la explosión de miles de toneladas de TNT. Y las temperaturas increíblemente elevadas que se obtienen en estas explosiones hacen posible la todavía mucho más espantosa reacción de fusión (abajo) de la bomba de hidrógeno.
Cuando los físicos europeos descubrieron en 1939 que el uranio emitía neutrones al partirse su núcleo, se preguntaron si no se podrían utilizar para partir otros núcleos e iniciar una reacción en cadena; eso fue finalmente conseguido en condiciones controladas en Chicago, en 1942. Pero, ¿sería posible utilizar una reacción en cadena incontrolada para fabricar una bomba? La contestación a esta pregunta, fue una explosión devastadora en el desierto de Nuevo México, en 1945: la primera explosión atómica de la Historia.

UNA DAMA CON TIARA DE FUEGO. La nube en forma de hongo de una explosión nuclear se eleva 13.000 metros en el aire del desierto de Nevada durante un ensayo militar llamado «Priscilla» en 1957. La franja brillante de la nube superior es el borde de la bola de fuego. Esta explosión de 37 kilotoneladas se produjo desde un globo a 200 m (Una kilotonelada = a 1.000 toneladas)
Un gnomo atómico para excavar una gruta
"Átomos para la Paz" es un slogan popular en el mundo de la postguerra, y el programa del Gobierno de los EE. UU., "Programa Reja de Arado" tiene por objeto convertirlo en realidad. En diciembre de 1961, el "Proyecto Gnomo", del Reja de Arado, perforó un pozo vertical de 360 metros en el desierto de Nevada, excavó un túnel horizontal de 335 metros de longitud y colocó una pequeña bomba atómica (de 3,1 kilotoneladas). Los científicos del Gnomo hicieron detonar la bomba. El resultado fue la primera gruta atómica de factura humana (abajo).

UNA BURBUJA DE SAL NUCLEAR. A una profundidad igual a la altura del Empire State Building, el científico contempla con asombro la obra de Gnomo. Al estallar en un lecho de sal de roca, la bomba produjo una gran burbuja que fundió la sal, formando una cavidad casi esférica. La mitad inferior está lleno de residuos; se volvió azul, verde y violeta por el intenso calor.
Cinco meses más tarde los científicos entraron en la gruta, a través de un pequeño agujero. La cavidad tenía 50 metros de ancho y 24 de altura. La temperatura era aún de 60° C, pero prácticamente toda la radiactividad había desaparecido o se encontraba debajo de los residuos.
Gnomo resultó de utilidad para el estudio de la posibilidad del empleo de semejantes explosiones en la extracción de mineral, de petróleo, o para formar depósitos de agua. También demostró que había algo que no podía hacerse; poco después de la explosión se vertió agua en la cavidad; gran parte del vapor se escapó por los intersticios, y el que subió a la superficie estaba demasiado lleno de minerales corrosivos para poder ser utilizado.
PLANO PARA UN CAVADOR DE GRUTAS. Este diagrama en sección de la primero explosión atómica subterránea muestro el pozo del ascensor, el túnel subterráneo hasta el lugar de lo explosión, la explosión, y los cables que comunicaban información sobre la explosión. Docenas de instrumentos fueron enterrados a diversos niveles del suelo. Estaciones sísmicos por todo el mundo registraron lo sacudido.

Estas cuatro fotos de una película muestran cómo el suelo del desierto se eleva a una altura de 90 metros después de la explosión de «Proyecto Sedan». La primera se tomó un cuarto de segundo después de la detonación; la última, dos segundos y tres cuartos más tarde.
Una pala nuclear excava un cráter de 400 metros
La cúpula de arena de más arriba es el resultado de la explosión de una bomba de hidrógeno enterrada 180 metros bajo tierra. El desierto hirvió con la radiactividad. Cuando se posó el polvo, el agujero de más abajo, de cuatrocientos metros de diámetro quedó como testimonio de la potencia de las bombas termonucleares.

Este ensayo, llamado "Proyecto Sedan" fue otro de los del Programa Reja de Arado. Difería de la explosión Gnomo descrita en páginas anteriores en cuanto su objeto era construir un gigantesco cráter abierto y no una gruta subterránea. Fue una explosión "limpia" porque por lo menos el 70 % de su energía procedía de fusión, y no de la "sucia" escisión: y los residuos que cayeron de nuevo sobre el cráter formaron una capa que enterró los productos radiactivos a gran profundidad. Como todos los programas Reja de Arado, éste no era militar. Para 1980, explosiones de este tipo harán posible proyectos de excavación gigantesca, tales como la construcción de un nuevo canal a través del istmo de Panamá: este trabajo podría hacerse con 651 bombas-H de una potencia total de 42 megatoneladas. (Una megatonelada es igual a un millón de toneladas de TNT.) Construirlo con los explosivos corrientes costaría cerca de seis mil millones de dólares, pero utilizando explosivos nucleares, solamente un poco más de dos mil millones.
Abundancia global del control de escisión
No todas las reacciones nucleares en cadena determinan explosiones devastadoras como las representadas en las páginas precedentes. En realidad, la utilización pacífica de la energía atómica se basa en el hecho de que una reacción de escisión en cadena puede ser fácilmente controlada.
El uranio inestable del núcleo de un reactor comienza a desintegrarse cuando es alcanzado por neutrones, y genera nuevos neutrones además de calor. Estos neutrones bombardean y dividen otros átomos de uranio en una reacción en cadena susceptible de ser controlada por medio de varillas que pueden entrar y salir en el reactor. Las varillas son de sustancias que absorben neutrones, como boro, cadmio y hafnio. Este control, que libera lentamente la energía atómica, es lo que hace que la escisión nuclear en un reactor sea diferente de la explosión instantánea incontrolada de una bomba atómica.
| PORTUGAL: SIGNO DE ESCISIÓN. El trabajador sostiene un letrero que dice «Reactor Portugués para Investigación» y se refiere al centro de investigación de Sacavem en Portugal. El reactor de Sacavem está a disposición de los estudiantes de los Universidades de Lisboa y Coímbra. Terminado en 1961, fue el decimoquinto reactor nuclear del programa de «Átomos para la Paz». |
Veinte años después de la primera reacción en cadena de 1942, había casi 400 reactores nucleares en el mundo: 285 en los Estados Unidos, 39 en Gran Bretaña, 39 en la Unión Soviética, 18 en Alemania Occidental, 14 en Italia, 11 en Japón y 10 en Canadá. La mayor parte de éstos son reactores de escasa potencia, construidos para investigaciones, como los tres de Escocia, India y Portugal que mostramos en estas páginas. Pero otros muchos son reactores de gran potencia, para la generación de electricidad, como el Yankee de Nueva Inglaterra.

UN YANQUI TRABAJADOR. Una blanca cúpula en el paisaje helado de Nueva Inglaterra: la Central Eléctrica Atómica «Yanqui» de Rowe, Massachusetts. Es la primera central nuclear de Nueva Inglaterra. La «Yanqui» empezó a funcionar en 1961, produciendo, con sus 23 toneladas iniciales de uranio, energía para abastecer todas las casas de Boston durante dos años. El proyecto «Yanqui» comprende 10 compañías.

INDIA: UN REGALO DE LA COMMONWEALTH. Los trabajadores de la fotografía están nivelando terreno para la construcción del «Reactor Canadá-India», cerca de Bombay. El material y el personal fueron suministrados por el Canadá, la mano de obra y la construcción, por la India. Completado en 1961, fue descrito por el primer ministro Nehru como «símbolo de cómo se ha encogido el mundo».

ESCOCIA: EXCEDENTE BIENVENIDO. Situado en el emplazamiento de una antigua base aérea en el norte de Escocia, el reactor experimental de Dounreay domina el Atlántico del Norte. Dounreay, que comenzó a funcionar en 1959, fue construido para investigación, pero toda la electricidad que le sobra se inyecta a las líneas de Escocia. El Reino Unido tiene más plantas nucleares que cualquier país.
Una caldera de vapor calentada por átomos
Las imágenes de estas páginas corresponden al gran reactor nuclear de Shippingport, cerca de Pittsburgh, Pennsylvania. Esta fue la primera planta de energía atómica en gran escala de los EEUU dedicada exclusivamente a generar electricidad. Fue construida en 1957 como un experimento para tantear los problemas y los costos de la conversión del calor de las reacciones de escisión atómica en cadena en energía eléctrica.
El reactor comenzó a trabajar con 75 kilogramos de uranio enriquecido rodeado por una envoltura de dióxido de uranio de 14 toneladas. Al principio la mitad de la potencia del reactor proviene del uranio enriquecido, pero la reacción de escisión convierte lentamente el dióxido de uranio en plutonio muy reactivo, el cual produce una parte creciente de la energía. La primera carga de U-235 mantuvo en funcionamiento el reactor dos años y un día. Se está ampliando el reactor desde una producción de 60.000 kilowatios, energía suficiente para 225.000 personas, a 100.000 kilowatios. La fábrica tiene una plantilla de 240 personas.
El inspirador del proyecto fue el almirante Hyman Rickover, padre de la flota nuclear de los EEUU. El reactor, patrocinado por el Gobierno fue construido por Westinghouse y la Duquesne Light Company con un costo de 110 millones de dólares. Su éxito ha sido totalmente definitivo.
| FRÍO PARA UN CORAZÓN CALIENTE. La cubierta que mostramos aquí arriba contiene el corazón del reactor de Shippingport; el núcleo reactivo. Cada hora circulan por lo cubierta unos doce millones de litros de agua, que conducen el gran calor del reactor al cambiador de calor (diagrama de abajo). Fabricada de acero al carbono y examinada a los rayos-X, solo la cubierta pesa 235 toneladas. |
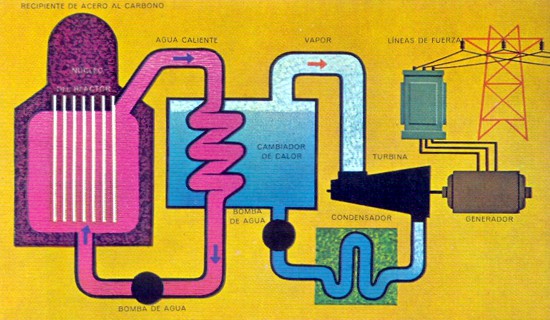
DEL ÁTOMO AL AGUA Y AL ALAMBRE. El núcleo radiactivo del reactor nuclear (arriba) calienta agua a presión, para evitar que se convierta en vapor, a 290° C. Esta agua transfiere su calor a un segundo sistema de agua en un cambiador de calor, donde se forma vapor que acciona una turbina, la cual impulsa el generador, que envía electricidad a las líneas de fuerza. Entretanto el vapor se vuelve a convertir en agua en un condensador y por medio de una bomba se hace pasar al cambiador de calor, para otro ciclo. El agua vuelve al reactor para ser recalentada.

LO FUNDAMENTAL DEL APARATO. Visto en construcción, a la izquierda, está el núcleo del reactor de Shippingport. Unos ingenieros en bata blanca están ajustando las largas varillas cilíndricas que contienen hafnio, elemento que retarda lo reacción en cadena del uranio. Luego el núcleo se protege con capas de acero inoxidable, agua y hormigón, y el todo se encierra en la cubierta representado arriba.
Los cohetes más potentes de hoy parecerán algún día juguetes, comparados con los provistos de motores tales como el llamado "Kiwi", que vemos en prueba. El secreto de esta revolución en cohetes son unos reactores nucleares tan pequeños que pueden ser utilizados para impulsar cohetes por el espacio. Los primeros reactores para transporte fueron instalados en barcos y submarinos, e incluso se han propuesto pequeños reactores para máquinas de aviación.

UN REACTOR QUE CUELGA DE UN HILO A fin de estudiar la manera de proteger la tripulación de un avión a propulsión nuclear de los mortales rayos de su propia máquina, se ha colgado este reactor atómico entre dos torres de unos cien metros de alto, en Oak Ridge, Tennessee. Los científicos observan bajo tierra por televisión, y miden la radiación con instrumentos instalados en el detector.
Pero hasta ahora el progreso más notorio en reactores ligeros, en miniatura, se realiza en el "Proyecto Rover", cuyo objeto es ensayar reactores nucleares para uso en máquinas para cohetes. La información que se obtenga con estos ensayos se utilizará para construir un cohete nuclear que pueda impulsar un vehículo al espacio.
Un reactor para cohete debe tener condiciones que no son necesarias en los reactores ordinarios. Lo mismo que otras muchas máquinas no nucleares para cohetes, Kiwi utiliza hidrógeno. Pero en las máquinas corrientes, el hidrógeno se quema, y los productos de combustión al expansionarse impulsan el cohete. En una máquina nuclear no se quema nada; el enorme calor del reactor es todo lo que se necesita para expulsar el hidrógeno por la boquilla. Y dentro de pocos años será la potencia combinada de cohetes tales lo que permitirá al hombre elevarse hasta las profundidades del sistema solar.
| UN REACTOR BOCA ABAJO. El «Kiwi A» entra en acción en su terreno de ensayo de Nevada. El corazón de Kiwi es un reactor nuclear cuya función es calentar hidrógeno a elevada temperatura tan rápidamente que su expansión lo impulse con violencia a través de la boquilla. Para impedir que se levante del suelo, el Kiwi se ensaya boca abajo. En condiciones normales no se produce humo en el funcionamiento del reactor, pero se le inyecta a la máquina para poder seguir la nube de escape radiactiva, que sería invisible. Kiwi es el nombre de un pájaro de Nuevo Zelanda. |
Cómo detener la muerte invisible
Cuando se descubrió la radiactividad en 1895, los científicos desconocían los peligros de esta nueva forma de radiación invisible. Pronto lo aprendieron; los experimentadores y los técnicos que trabajaban con radio sufrieron serias quemaduras por exceso de exposición, y la descubridora del radio, Mme. Curie, finalmente falleció de los efectos de su trabajo. Acabó por comprenderse que la radiación podía ocasionar cáncer y destruir huesos y órganos vitales. Puede también dañar solapadamente a los genes, estructuras del cuerpo que regulan la herencia, y los niños nacidos de padres expuestos a radiación pueden sufrir deformidades espantosas.
La aparición de las bombas atómicas, y la utilización pacífica de la energía atómica agudizaron tanto el problema de la radiación que en 1959 el Congreso de los Estados de padres expuestos a radiación puede Radiación para proteger a los trabajadores en la nueva industria. Ya mucho antes de esa fecha existían aparatos de seguridad tales como el contador de Geiger para medir la intensidad de la radiación. Luego aparecieron una serie de protecciones industriales como el traje de plástico de la derecha, campanas que suenan cuando la radiación de un local llega al punto peligroso, y "esclavos" robot que manipulan objetos peligrosos. La magnitud de la tarea de hacer inofensiva la energía nuclear viene indicada por el hecho de que una planta de energía atómica de un costo estimado en 12 millones de dólares valdría un millón, si se prescindiese de las complicadas precauciones.
| LA HORRIBLE ALUCINACIÓN DE HOMERO. Los técnicos están protegidos del mortífero polvo de plutonio de un «local caliente» por un ingenioso traje de polietileno que hace que parezcan visitantes de otro planeta. Llamado «La horrible alucinación de Hornero, por el nombre de su inventor, Homer Moulthrop, este traje tiene una larga cola hueco que llega hasta un local contiguo seguro. |
| UN ROBOT PARA VENCER LA RADIACIÓN. Tras una ventana de un metro de espesor, a prueba de radiación, la mano en forma de pinza de un aparato robot llamado «esclavo-maestro» manipula una varilla radiactiva. El robot, en un laboratorio de Pleasanton, California, es guiado por el técnico de la derecha, mientras que un metalúrgico observa a través de un periscopio amplificador. |
Problema de eliminación de basuras "calientes"
Uno de los problemas más espinosos que se presentan al ingeniero nuclear es la eliminación de los inevitables productos secundarios de la escisión que son demasiado "calientes" para ser manipulados. Por la puerta de atrás de una instalación nuclear salen una serie de productos contaminados: agua de lavar los uniformes de los trabajadores, toallas, etc. Como sólo el tiempo, unos 100 años, puede neutralizar la mayor parte de estos desperdicios, es preciso acondicionarlos cuidadosamente.
Casi la totalidad de los desperdicios de escisión se entierran o bien en la tierra o en el mar (ver imágenes). El mar es evidentemente el lugar indicado, pero el peligro de pérdidas y de contaminación de grandes masas del océano, hacen la operación tan delicada que solamente se tratan así los desperdicios de poca radiactividad. La mayor parte de la materia realmente "caliente" se almacena bajo tierra en tanques o bóvedas especiales de acero y hormigón, que tienen que ser continuamente observadas por si perdiesen.
Se está adelantando en la búsqueda de nuevos métodos de almacenamiento, y existe la posibilidad de que se usen minas de sal subterráneas. Pero el problema es urgente: para el año 2000, las plantas nucleares producirán 1.000 millones de litros de basura "sucia" por año.

LA TUMBA DE LA ESCISIÓN. Unas excavadoras entierran un «ataúd» de más de 200 metros cúbicos que contiene 15 toneladas de maquinaria anticuada de reactor de plutonio, mientras un trabajador protegido contra la radiación comprueba la radiactividad. Este cementerio de 8 hectáreas es el lugar de descanso de los residuos de la Planta Atómica de Hanford en Washington.

UNA PRISIÓN DE ARCILLA. Estas seis bolas de arcilla que se aprecian en el grabado, han sido impregnadas con un líquido radiactivo peligroso, pero al calentar la arcilla a 1.200° C se ha encerrado eficazmente la radiactividad en el interior de las bolas: este nuevo método para solidificar y eliminar desperdicios líquidos «calientes», se llama «fijación esponjosa».

UN ENTIERRO SALADO- El cajón de hormigón que está a punto de ser arrojado al agua desde el cúter Cherokee, de la Guardia Costera de los EEUU, contiene una carga peligrosa de residuos radiactivos. Es parte de un cargamento de 25 toneladas de desperdicios radiactivos en el Distrito de Columbia. Esos cajones, arrojados al este de Norfolk, Virginia, durarán 100 años.
Receta radiactiva para mantener sano el ganado
El moscón azul ha sido siempre una plaga del ganado del Sur. Incubado de huevos puestos en arañazos y cortes, los gusanos pueden matar un novillo en 10 días. Y no obstante, en estos últimos años, los aviones han dejado caer más de ocho mil millones de moscas vivas.

La herida de una cabra llena de larvas. Las moscas son de 12 mm de largo. Las larvas crecen en la carne del ganado.
¿La razón? Todos aquellos miles de millones habían sido esterilizados. Y si una hembra de moscón azul se une con un macho estéril, sus huevos son estériles. En Curaçao, un proyecto similar los exterminó en un año. El secreto de este control de plaga son los isótopos radiactivos.

ÁTOMOS CONTRA EL MOSCÓN AZUL. Cuando los huevos del moscón azul se han convertido en crisálidas, se introducen en una lata como la de la izquierda de la fotografía de encima y se esterilizan con los rayos gamma del radioisótopo cobalto 60. Los machos estériles compiten en aparearse con las hembras.
Los radioisótopos son primos inestables de elementos químicos ordinarios, que se están desintegrando constantemente y emitiendo rayos. Como toda radiactividad, estos rayos son peligrosos; pero se pueden utilizar para la esterilización del moscón.
Los radioisótopos pueden también matar células cancerosas, y como su radiactividad puede ser detectada, se utilizan como indicadores para informar sobre el flujo de los jugos digestivos, o del petróleo en oleoductos. Hasta se utilizan como fuente de energía en estaciones meteorológicas árticas sin personal. Los isótopos dan al hombre la idea de que el espectro de la radiactividad tiene sus aspectos beneficiosos.
| NO SE PUEDE ELUDIR LA ESTERILIZACIÓN. En la mayor fábrica, de moscones azules de Texas, el Dr. W. L. Tarver suelta 4.500 moscones azules estériles en medio de su planta con el objeto que puedan aparearse, y así esterilizar las moscas que pudieran haber escapado y estén dando vueltas por la fábrica. |
Capítulo 8
E= mc2: La Substancia Puesta a Trabajar
PRÓLOGO DE UNA NUEVA ERA. La histórica ilustración es la primera fotografía de una escisión nuclear, y muestra una pantalla fluorescente marcada por imágenes de explosiones a manera de proyectiles de energía, en un ciclotrón de la Universidad de Columbia, Nueva York, en 1939. Esta experiencia en la ruptura de átomos llevó a la primera reacción nuclear, Chicago, 1942.
El día 2 de diciembre de 1942, un grupo de 39 científicos, entre ellos una mujer, rodeaban al gran físico italiano Enrico Fermi en la pista de «squash» del Stagg Field de la Universidad de Chicago. Esperaban con ansiedad, mientras una gran pila de uranio y grafito iba siendo sometida con lentitud a un ensayo definitivo. A las 3,25 de la tarde, en medio del silencio del grupo, y mientras sonaban los contadores de neutrones, la tensión de Fermi comenzó a relajarse: «La reacción en cadena, dijo mirando en derredor, se mantiene por sí misma».
Tal fue el momento culminante de tres años de esfuerzos encaminados a forzar el curso de la naturaleza. En 1939 los experimentos de Otto Hahn y Fritz Strassmann habían demostrado que cuando se bombardea uranio con neutrones, algunos de sus átomos se dividen en fragmentos más ligeros. Parte de la masa desaparece en esa fragmentación, pues parte del átomo de uranio se convierte en energía. Un neutrón basta para dividir un átomo, e incluso ese neutrón es solamente invertido y no se pierde; en los residuos se encuentran, por término medio, dos o tres neutrones más. Estos neutrones pueden a su vez dividir otros dos o tres átomos, liberando más energía, y de cuatro a nueve neutrones más. Si cada uno de éstos consigue dividir otro átomo, la siguiente fase de la reacción producirá entre ocho y 27 neutrones, y así sucesivamente. De esta manera la «reacción en cadena», que así se la llama, avanzaría cada vez más aceleradamente.
Pero lo que ocurre en teoría y lo que sucede en la práctica son dos cosas diferentes; muchos de los neutrones no llegan a dividir otro átomo, y cada vez que dejan de hacerlo la reacción en cadena se debilita. Los científicos atómicos pronto se dieron cuenta de que para liberar energía del uranio en gran escala había que encontrar alguna manera de hacer que la reacción en cadena se mantuviese por sí misma; había que idear algún método para asegurarse de que suficientes neutrones alcanzaban suficientes núcleos y los dividían.
En 1942 la pila de Fermi de uranio y grafito consiguió hacerlo. Fermi había observado experimentalmente que los neutrones lentos eran más eficaces para la escisión que los que se mueven a mayores velocidades. Pero la mayor parte de los neutrones liberados en la ruptura de un núcleo son rápidos. Para que la reacción en cadena fuese una realidad, se tenía que hallar la manera de retardar aquellos neutrones hasta velocidades en que fuesen eficaces.
Fermi sabía que los núcleos de ciertos materiales tales como el grafito, forma pura del carbón, no presentan casi ninguna tendencia a absorber neutrones, los cuales sencillamente rebotan en sus núcleos como una pelota de goma en una pared de cemento. Existen, por otra parte, sustancias de núcleos esponjosos que absorben todos los neutrones que pasan sin sufrir en apariencia ningún daño por el ataque. Una combinación de núcleos inmunes y absorbentes proporcionó a Fermi el instrumento que necesitaba para controlar delicadamente la ruptura nuclear.
Fermi incrustó en una gran masa de grafito el combustible de uranio para la reacción, razonando que los electrones rápidos creados por la división nuclear, al rebotar contra el grafito, se retardarían, convirtiéndose en proyectiles más eficientes para atacar los pequeños núcleos del uranio y dividirlos en dos. Pero si el experimento tenía éxito, se presentaba el peligro de una reacción nuclear incontrolada. A fin de controlar el curso de la reacción, Fermi decidió insertar en la pila algunas varillas de una sustancia que absorbiera neutrones. En el presente caso el material elegido fue el cadmio, metal bastante raro, emparentado con el cinc ordinario. Se dispusieron las varillas de manera que pudieran ser metidas y sacadas de la pila, según se necesitase retardar o acelerar la reacción.
La situación en delicado equilibrio
Cuando Fermi anunció a sus colegas que la reacción se mantenía por sí misma, significaba que el grafito estaba retardando justo el número suficiente de neutrones para mantener la reacción. Y que el cadmio absorbía el número suficiente para evitar que se fuese de la mano.
El éxito obtenido en la cancha de Stagg Field demostraba que tanto la bomba atómica como la utilización pacífica de la energía atómica eran posibles. Si se construía una pila sin las varillas de cadmio, la reacción en cadena avanzaría desenfrenada. Por otra parte, el control de la reacción por medio del cadmio, o cualquier otro absorbente, ofrecía la clave para la generación ordenada de la energía atómica. Tal iba a ser el principio fundamental de los reactores atómicos que ahora producen fuerza eléctrica para un número creciente de ciudades de todo el mundo.
Pero desde 1942, cuando se consiguió la primera reacción en cadena, habían de transcurrir más de dos años y medio para que en 1945 detonase la primera bomba atómica. Entre tanto, se invirtió el trabajo de 500.000 hombres y mujeres y dos mil millones de dólares en el inmenso Proyecto Manhattan, el mayor intento industrial jamás emprendido por el hombre, que tenía por objeto convertir el experimento de Stagg Field en la realidad de una bomba atómica. Obtener los materiales necesarios para los experimentos no fue problema pequeño. El grafito, por ejemplo, es una sustancia bastante común, que se usa mucho para lápices y lubricantes, pero a principios del año 1940 prácticamente no existía de la pureza necesaria para una pila atómica. En consecuencia, y en medio de las escaseces de la guerra, la industria del grafito tuvo que renovar a fondo sus técnicas.
El metal uranio era otro material crítico. Antes de la segunda Guerra Mundial el uranio era poco más que una curiosidad de laboratorio. En todo el mundo no había ni medio kilogramo de uranio puro. En los Estados Unidos no se extraía, y solamente podía disponerse de un poco entre los productos secundarios indeseables de las grandes refinerías del metal vanadio, en las Rocosas. En 1942 se disponía de unas 500 toneladas de esos desperdicios de uranio. En el Ártico Canadiense había unas cuantas minas uranio-radio, entre ellas la famosa mina Eldorado en el Gran Lago de los Osos, capaz de producir unas 300 toneladas de mineral al año. Pero por un gran azar afortunado, los Estados Unidos se encontraron con la custodia de 1.200 toneladas de óxido de uranio que habían sido almacenadas en Staten Island por una empresa minera del Congo Belga. Antes de la guerra el Congo era el mayor productor de radio y uranio; cuando los alemanes invadieron Bélgica se cerraron las minas y se las llenó de agua para evitar que cayesen en manos de los alemanes si éstos llegaban a ocupar el Congo. Así, pues, al iniciarse el programa atómico en 1942, los Estados Unidos poseían unas 2.000 toneladas de mineral de uranio, por suerte lo suficiente para todo el proyecto de la bomba atómica.
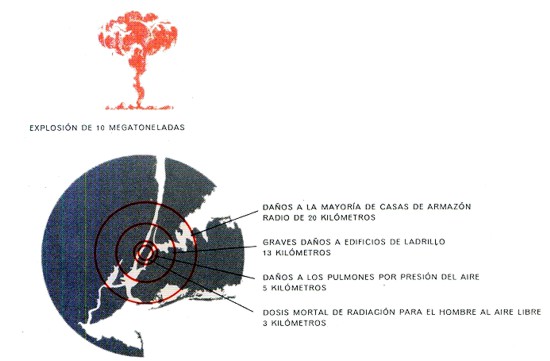
ESFERAS DE INFLUENCIA MORTÍFERAS. En una explosión aérea sobre Manhattan, el poder destructor de una bomba de fusión equivalente a 10 millones de toneladas de TNT probablemente mataría a todos los seres humanos no protegidos dentro de un círculo de seis kilómetros de diámetro. Las causas primarias del efecto mortífero son los neutrones, los rayos gamma, el fogonazo de color y luz, y una ola explosiva de aire a gran presión. Los efectos secundarios son las tempestades de fuego.
Pero el uranio no era por sí mismo la solución. Incluso cuando es 100 por 100 puro, el uranio ordinario es demasiado voluminoso y demasiado estable para poder ser utilizado en una bomba. Así, por ejemplo, en la pila de Fermi, en Chicago, se habían necesitado siete toneladas para conseguir una reacción en cadena relativamente lenta. Para un arma que tenía que ser conducida en un avión, se necesitaba algo más ligero y más potente. Afortunadamente, esa forma muy reactiva de uranio existe, pero antes de que los físicos pudiesen utilizar tal elíxir, tenían que desarrollar un proceso industrial en gran escala para separarlo del uranio más estable, con el cual está siempre íntimamente mezclado.
La historia de esta realización tiene sus raíces en el principio del siglo. Después del descubrimiento de la radiactividad por Henri Becquerel en 1896, los físicos se propusieron como uno de sus principales objetivos comprender cómo está estructurado un átomo. En la primera década del siglo XX se admitía en general que un átomo era una masa esférica submicroscópica de carga positiva en la cual flotaban electrones de carga negativa, algo así como las pasas en un pastel. Las sumas de las cargas negativas de los electrones igualaban la carga positiva del átomo; visto desde fuera, el átomo en conjunto era eléctricamente neutro.
Adiós al pastel de pasas
En 1911 esta imagen se desvaneció cuando lord Rutherford publicó un debate sobre los experimentos efectuados por él y sus asociados en el famoso Cavendish Laboratory de Cambridge, Inglaterra. En Cavendish los científicos habían montado un aparato en el cual sé rociaba una hoja de oro o platino con un chorro de partículas alfa (productos de la desintegración radiactiva, grandes y relativamente lentos, de carga eléctrica positiva). La mayor parte de las partículas pasaban a través de la hoja metálica, pero, ante el asombro de todos, algunas rebotaron hacia atrás. Según Rutherford hizo observar más tarde, era algo tan increíble como ver un proyectil de artillería de 35 centímetros que rebotase en una hoja de papel de seda.
De los resultados de este experimento Rutherford dedujo que el átomo debe ser de estructura muy abierta, puesto que tantas partículas alfa pasaban a su través. Pero también se dio cuenta de que debe tener como centro un núcleo macizo de carga positiva, pues sólo un cuerpo cargado positivamente podía haber repelido con tanta eficacia unas partículas alfa cargadas positivamente. Rutherford dedujo que, si el núcleo era positivo, los electrones no podían estar incrustados en él; deben estar lo suficientemente lejos para que su carga negativa no anule la carga positiva del núcleo. Era evidente que había que abandonar la imagen de las «pasas en el pastel».
Hoy, gracias al trabajo de Rutherford y sus sucesores, sabemos que, si bien la mayor parte de la masa está concentrada en el núcleo de un átomo, el volumen del núcleo es pequeño en relación con el volumen total del átomo que comprende los electrones. Actualmente se considera que el radio de un átomo es de unas cien millonésimas de centímetro. Muy a su interior se encuentra el núcleo atómico, de un radio tan pequeño que va de una diezmilésima a una cienmilésima del radio del átomo. Si se hinchase una bola de uranio de un centímetro de diámetro hasta el tamaño de la tierra, un átomo de uranio tendría, un centímetro de diámetro. Y el núcleo del átomo tendría solamente una diezmilésima de centímetro.
La naturaleza del núcleo mismo sólo ha sido esclarecida después de una serie de hipótesis muy imaginativas. La primera postulaba la existencia de una partícula, llamada «protón» en el interior del núcleo. Ahora sabemos que tiene una masa unas 2000 veces mayor que la del electrón. El protón tiene también una carga eléctrica igual a la del electrón, pero su carga es positiva, mientras que la del electrón es negativa. El hidrógeno, por ejemplo, que es el átomo más sencillo, consta de un electrón que gira alrededor de un protón y, como las cargas eléctricas son iguales y opuestas, se neutralizan en relación a cualquier observador externo. La masa del átomo de hidrógeno es prácticamente la misma que la masa del protón.
El número de protones en el núcleo de un átomo varía de sustancia a sustancia. Los núcleos de helio, por ejemplo, contienen dos protones; los núcleos de carbono, seis; los núcleos de uranio, 92, y cada núcleo está rodeado de tantos electrones como protones tiene, pero, salvo para el hidrógeno ordinario, el peso de los núcleos es siempre mucho mayor que el peso de todos sus protones. El núcleo contiene algo, además de protones, algo que no tiene carga eléctrica, pues si la tuviese el átomo ya no sería neutro.
Una predicción y su confirmación
Ya en 1920, Rutherford había predicho la existencia de tal componente nuclear sin carga, pero durante otra década los físicos fracasaron en la búsqueda de esa partícula, que habían denominado neutrón. Luego comenzaron a presentarse una serie de curiosos resultados en el curso de experimentos con la sustancia berilio, realizados desde 1930 a 1932 por Walter Bothe y Hans Becker en Alemania, e Irene y Frédéric Joliot-Curie en Francia. Cuando se bombardeaba el berilio con partículas alfa emitía una misteriosa radiación que al principio se consideraba como una especie de rayo gamma. Finalmente, James Chadwick, en Inglaterra, demostró que la radiación consistía en partículas de masa aproximadamente igual a la del protón, pero sin carga eléctrica. Sin duda, se trataba de los neutrones predichos por Rutherford.
Desde entonces los experimentos han demostrado que los núcleos de una sustancia determinada tienen siempre el mismo número de protones, pero pueden contener un número diferente de neutrones. Por ejemplo, el núcleo del elemento carbono, que tiene seis protones, contiene a veces seis neutrones y a veces siete. Tales formas, que solamente difieren por su número de neutrones, se llaman «isótopos». Sus símbolos químicos se escriben indicando el número conjunto de protones y electrones (aproximadamente su peso atómico) después del símbolo del elemento. En el caso del carbono, que acabamos de reseñar, las dos formas pueden escribirse C12 y C13. El C12 es la forma más corriente; la C13 sólo aparece una vez por cada cien átomos de carbono.

ALCANCE DEL PELIGRO DE LA GRAN BOMBA. Descargada sobre Manhattan, una bomba-H de una potencia 10 veces mayor que la bomba de millones de toneladas de la página de enfrente, ocasionaría menos de 10 veces de daños. No se ha hecho nunca estallar una bomba de 100 megatoneladas, pero la U.R.S.S. ha ensayado un artificio de 60 megatoneladas, y se cree que un artificio similar podría ser aumentado hasta las 100 megatoneladas
Del uranio, como del carbono, existen varios isótopos, siendo ésta la característica utilizada por el proyecto atómico de los EEUU. Los isótopos más corrientes del uranio son U238 y U235. El segundo es el isótopo escindible, pero el primero es, con mucho, el más abundante, un 99,3 % de la mezcla de uranio en que ambos se encuentran. Puesto que ambos isótopos tienen propiedades químicas idénticas, lo mismo que todos los isótopos de una misma sustancia, no existe procedimiento químico sencillo que permita separarlos, y el que se utilizó se basaba en el peso atómico, en el hecho de que el U238 es algo más pesado que el U235, puesto que, según indican los números 238 y 235, su núcleo contiene tres neutrones más que el otro.
Es evidente que los átomos son demasiado pequeños para poder ser separados individualmente, pero cuando el uranio se combina con el gas flúor, forma un compuesto gaseoso cuyas moléculas pueden ser separadas. Sabiendo que las moléculas ligeras se mueven algo más de prisa que las más pesadas, los científicos idearon un procedimiento de «difusión gaseosa» en el cual el hexafluoruro de uranio es impulsado contra un tamiz extremadamente fino. Las moléculas más ligeras y más rápidas pasan a través de la pantalla un poco más de prisa que las más pesadas y lentas. En consecuencia, el gas que se acumula al otro lado de la pantalla tiene una concentración mayor de U235 que el gas que queda atrás. Repitiendo esta operación varios miles de veces, y utilizando en cada ocasión el gas refinado obtenido en la operación previa, es posible, teóricamente por lo menos, aumentar la concentración del U235 de 0,7 en la mezcla hasta un asombroso 95 %. Gracias a este procedimiento, los EEUU habían encontrado la manera de obtener un concentrado de uranio que podía ser utilizado en una bomba, o así lo pareció entonces.
Uno de los mayores logros del proyecto atómico de guerra de los Estados Unidos fue la construcción de una gigantesca planta de difusión gaseosa en Oak-Ridge, Tennessee, para efectuar la concentración de U235 en gran escala. La planta tenía unos 800 metros de largo y al final acabó costando más de 500 millones de dólares.
Para intentar desarrollar otros métodos de refinar el U235 a fin de que pudiese ser utilizado en una bomba transportada en avión, el gobierno construyó una serie de plantas junto a la planta de difusión gaseosa de Oak-Ridge. Construidas a un costo de más de 300 millones de dólares, estas plantas fueron ideadas para concentrar U235, haciendo pasar tetracloruro de uranio cargado eléctricamente a través de un potente campo magnético. En el proceso, las trayectorias de las partículas U238, algo más pesadas, serían menos desviadas por el campo que las de las más ligeras U235. Así se separarían los dos isótopos del uranio.
Al final fue por el procedimiento magnético que primero se consiguió producir un concentrado de U235 de un 85% de pureza, más que suficiente para su uso en la bomba.
Pero mucho antes de terminar las plantas de Oak-Ridge, el gobierno decidió iniciar un proyecto completamente distinto, por si los otros fracasaban. Así fue que en un lugar solitario junto al río Columbia, cerca del pueblo de Hanford, Washington, se construyó una nueva planta para producir una sustancia llamada plutonio. El corazón de la instalación de Hanford eran varias pilas atómicas gigantescas derivadas del prototipo de Fermi en Stagg Field. A diferencia de la bomba de aviación, esas pilas podían construirse con uranio corriente. Una vez terminada, se dejaba que la pila funcionase lentamente en reacción en cadena controlada, que se refrigeraba con agua del río Columbia. En el interior de la pila se producía una extraña transformación. Parte del uranio, el U238, al ser bombardeado con neutrones, se convertía en plutonio, elemento de factura humana, aún más fácil de dividir que el U235.
Lo único que había que hacer luego era separarlo del uranio, operación fácil de llevar a cabo por medios puramente químicos, puesto que el plutonio y el uranio son dos elementos químicos distintos, a diferencia de los químicamente semejantes isótopos U235 y U238.
Éxito inmediato del nuevo elemento
El plutonio fue utilizado en la primera bomba que estalló en Alamogordo, y en la bomba de Nagasaki. La bomba de Hiroshima utilizó el U235. Para el plutonio, descubierto sólo cinco años antes, fue la historia de un gran éxito. El mérito fue de un equipo de científicos de la Universidad de California, dirigidos por el doctor Glenn T. Seaborg, ahora Presidente de la Comisión para Energía Atómica de los EEUU. Habían comenzado su trabajo con otro elemento de fabricación humana, el neptunio, descubierto en 1940 por Edwin M. McMillan y Philip H. Abelson, también de la Facultad de California.
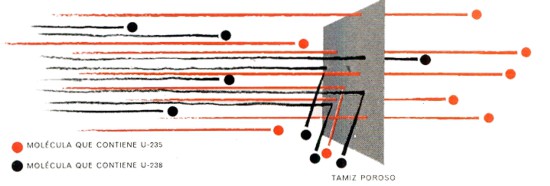
CRIBADO DE MOLÉCULAS. En la separación por difusión gaseosa del escaso y valioso isótopo uranio 235 del menos útil uranio 238, primero se combinan ambos con flúor formando el gas hexafluoruro de uranio. Cuando se fuerza la mezcla a través de un tamiz poroso fino, las moléculas de U235, que son algo más ligeras y se mueven más de prisa, penetran más fácilmente. Repitiendo muchas veces lo operación se llega a obtener una concentración suficiente de U235.
Comenzando su trabajo donde McMillan lo había dejado al ser destinado a trabajos sobre radar, Seaborg y sus asociados descubrieron que el neptunio se desintegraba radiactivamente, dando el elemento que llamaron plutonio. Entre otras cosas, hallaron que un isótopo del nuevo elemento se dividía bajo el bombardeo de neutrones, lo mismo que el U235. Fue el principio de un período muy fecundo, durante el cual Seaborg iba a contribuir al descubrimiento de otros nueve elementos transuranianos, y ganaría, junto con su amigo McMillan, el Premio Nobel de Química para 1951.
Pero antes de poder hacer estallar el plutonio sobre el Japón, los científicos se enfrentaron con serios problemas en el diseño de la bomba misma. Había que inventar algún sistema para evitar que algunos neutrones sueltos pudiesen automáticamente iniciar una reacción en cadena en la bomba, mientras estaba almacenada o a bordo del avión; al mismo tiempo la disposición había de ser lo suficientemente flexible para permitir la iniciación de una rápida reacción en cadena una vez se hubiese soltado la bomba. La solución consistió en dividir el material activo en dos o más partes, cada una de las cuales era demasiado pequeña para mantener por sí misma una reacción en cadena. Para crear la explosión las partes deberían ser juntadas por la detonación de pequeñas cargas de TNT.
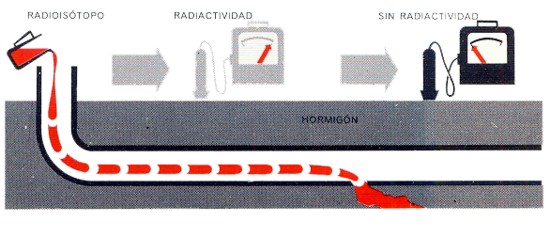
CÓMO BUSCAR ESCAPE CON YODO. Isótopos radiactivos corno el uranio 235 y el estroncio 90, son sobre todo conocidos por su papel en los bombas atómicas y su presencia en el «fallout» atómico. Pero el hombre tiene aplicaciones domésticas para muchos otros isótopos, desde el tratamiento del cáncer hasta la investigación de escapes en tuberías. Después de añadir yodo radiactivo al agua, los ingenieros pueden seguir su recorrido «observando» la radiactividad a través de las paredes de un edificio o de una acera, por medio de un contador Geiger (flechas grises). Cuando cesa la radiactividad, es que se ha localizado el escape.
Al llegar el verano de 1945 todos los problemas industriales y de diseño habían sido resueltos, y el 16 de julio de 1945, 21 meses después de la primera reacción en cadena en la pista de squash de Stagg Field, la primera arma nuclear del hombre hacía explosión en un ensayo en el desierto de Alamogordo, Nuevo Méjico. Tres meses más tarde, otra versión de la bomba caía sobre Hiroshima, y daba comienzo la era nuclear.
Poco después de que la bomba atómica terminara la segunda Guerra Mundial, los científicos propusieron un arma nuclear aún más potente: la bomba de hidrógeno. Se necesitaron siete años más de trabajo intensivo para convertirla en realidad, culminando en su primera explosión con éxito en el atolón de Eniwetok en noviembre de 1952.
La bomba de hidrógeno no es sencillamente la hermana mayor de la bomba atómica, sino que se basa en una transformación nuclear que parece ser la antítesis de la otra. Mientras la bomba atómica se funda en el fenómeno de «escisión» que divide núcleos, la bomba de hidrógeno depende de la «fusión», que los junta, y lo hace liberando aún más energía.
A primera vista eso podría considerarse una contradicción de la naturaleza: ¿cómo es posible que la escisión, ruptura de un núcleo en pequeños fragmentos, y la fusión, formación de un núcleo partiendo de fragmentos más pequeños, vayan ambas acompañadas de una liberación de energía?
La solución de este problema se encuentra en las fuerzas extraordinariamente complejas que mantienen junto el núcleo. La primera de ellas es la fuerza de la gravitación, si bien las masas de los protones y de los neutrones son tan pequeñas que los efectos gravitatorios son casi cero. Luego hay la fuerza electrostática, es decir, el efecto eléctrico de una partícula sobre otra. Pero como todas las partículas cargadas eléctricamente son protones con cargas positivas que se repelen mutuamente, la fuerza electrostática más bien parece contribuir a romper el núcleo que a mantenerlo junto. El hecho es que debe existir aún otra fuerza causante de la cohesión nuclear. Postulando su existencia, los físicos la llaman «fuerza nuclear».
- Esta fuerza nuclear se porta de manera tan complicada que los científicos no han podido aún comprenderla del todo. Sea lo que fuere, es de naturaleza muy particular: trata de la misma manera a los protones y a los neutrones;
- actúa a distancias pequeñísimas, siendo despreciable a distancias de más de cuatro veces el radio de un protón;
- normalmente es una fuerza de atracción, que puede ser 35 veces más potente que la fuerza electrostática entre dos protones, y
- se convierte en una fuerza de repulsión a distancias menores que los dos tercios del radio de un protón.
Los científicos creen que la fuerza nuclear y la fuerza electrostática disruptiva actúan oponiéndose, según el número y la disposición de los protones y los neutrones en el núcleo. En algunos elementos las fuerzas de atracción superan con mucho las fuerzas de repulsión, y el núcleo permanece estable y compacto. En otros elementos, las fuerzas de repulsión casi compensan las de atracción y el núcleo se convierte en un conjunto unido, pero suelto, pronto a disgregarse a la menor perturbación de sus componentes, como la intrusión de un protón en el fenómeno de escisión nuclear. Tanto en el U235 como en el plutonio los núcleos son del tipo inestable.
La energía relacionada con la combinación de las fuerzas nucleares y electrostáticas que mantienen junto al núcleo ha recibido el nombre de «energía de unión». En cierto sentido, un núcleo que se mantiene con gran energía de unión es como una puerta de paso con un muelle muy fuerte; se necesita mucha energía para abrirla, pero al cerrarse da un tremendo golpetazo. De la misma manera, se necesita mucha energía para abrir un núcleo de gran energía de unión, pero cuando vuelve a formarse tal núcleo se libera una cantidad tremenda de energía.
Gatillos atómicos y calor de fusión
En este concepto de energía han hallado los científicos una explicación de porqué tanto la fusión como la escisión liberan energía, aun cuando en principio la una parezca ser exactamente opuesta a la otra. El hecho decisivo es que si los átomos de los 103 elementos se ordenan en una hilera según su peso, del más ligero al más pesado, se encuentra que las energías de unión por protón y por neutrón aumentan progresivamente desde el elemento más ligero, hidrógeno, hasta el elemento medio, hierro. Luego van decreciendo progresivamente hacia los elementos más pesados.
Cuando dos núcleos de hidrógeno se unen en el proceso de fusión, produciendo un solo núcleo de helio, algo más pesado, que es lo que ocurre en la bomba de hidrógeno, la puerta de paso se cierra de golpe; se forma un nuevo núcleo de mucha energía de unión y se libera energía.
Por otra parte, cuando un núcleo de U235 se divide en el proceso de escisión, forma núcleos más pequeños que tienen también mayor energía de unión que el núcleo original. De nuevo se cierra de golpe la puerta y se produce energía.
Para llevar los núcleos de hidrógeno al punto en que se unan por fusión se necesitan temperaturas fantásticas, del orden de los millones de grados. Normalmente estas temperaturas existen solamente en el interior de estrellas tales como nuestro sol, el cual, dicho sea de paso, es frío entre las estrellas, y su velocidad de fusión es lo suficientemente pequeña para que no estalle como colosal bomba de hidrógeno. Ningún artificio corriente producido por la mano del hombre podría generar temperaturas lo suficientemente elevadas para producir una reacción de fusión sobre la tierra. Pero tales temperaturas se producen momentáneamente en la explosión de una bomba atómica. Y así, con pavorosa sencillez, se hace detonar una bomba de hidrógeno por medio de una o más bombas atómicas incorporadas en su mecanismo. Este artificio se llama «termonuclear», por depender del calor.
Como otras muchas invenciones nacidas de la guerra, las reacciones nucleares de factura humana han resultado fácilmente adaptables a usos pacíficos. Resulta irónico que su principal beneficio proceda del calor, que era considerado como producto secundario de la escisión nuclear hasta que fue utilizado para lograr la fusión termonuclear de la bomba de hidrógeno. El calor, sin duda, contribuye al efecto destructor de la explosión atómica, pero la concusión explosiva y el subsiguiente «fallout» radiactivo son los principales causantes de los daños. Por otra parte, aquella generación de calor es precisamente el único objeto por el cual se construyen reactores nucleares en tiempo de paz, puesto que puede ser utilizado para convertir agua en vapor que luego hace funcionar las turbinas que generan electricidad o sirven para la propulsión.
Se pueden emplear plantas de vapor móviles, accionadas por pequeños reactores nucleares, para hacer funcionar maquinaria que normalmente utiliza máquinas de vapor corrientes. Así, por ejemplo, los automóviles del futuro pueden muy bien ser Vapores Stanley a propulsión nuclear. Actualmente el uso más espectacular de tales reactores nucleares es en submarinos, posibilidad sugerida ya por Enrico Fermi en marzo de 1939. Su idea, casi olvidada durante los años de guerra, fue tenazmente defendida por el almirante Hyman Rickover, y finalmente la Armada de los EEUU se convenció de sus extraordinarias ventajas. El primer submarino atómico de los EEUU, el Nautilus, fue botado el 21 de enero de 1954 en Groton, Connecticut, y en su viaje inaugural superó con mucho a su homónimo de Julio Verne, al navegar 62.500 millas sin cargar combustible. Este viaje con motores normales hubiese consumido más de ocho millones de litros de aceite diesel.
Lo que la fuerza nuclear ha hecho para el submarino, puede hacerlo para el conjunto de la sociedad: es una nueva fuente de energía mayor que cualquier otra antes utilizada por el hombre. Por muchas razones, es la fuente de energía más prometedora para el futuro. En muchas partes del mundo se han construido reactores que utilizan reacciones de escisión. A fin de aprovechar las reservas mundiales de uranio, algunos se utilizan como «reactores de cría», para producir plutonio partiendo del U238.
El calor de la reacción de fusión del hidrógeno no ha sido utilizado aún con fines pacíficos; su materia prima, el hidrógeno, que es el más abundante de todos los elementos, se halla en cantidades inagotables en los océanos. Pero antes de poder utilizar su energía los científicos tienen que encontrar un recipiente en que tal reacción pueda producirse con seguridad, a pesar de que todas las sustancias sólidas conocidas de la tierra se evaporan a temperaturas que son realmente pequeñas fracciones de las que se producen en los procesos de fusión. Hasta ahora el intento de solución de más envergadura ha sido el proyecto de las llamadas «botellas magnéticas», artificios que utilizan potentes campos magnéticos que desvían continuamente partículas de hidrógeno con carga eléctrica, hacia recintos determinados. En estos experimentos los científicos sólo han conseguido éxitos parciales. No obstante, si hemos de aprender alguna lección de la historia de la ciencia, es la de que el problema se resolverá en menos tiempo del que se supone y por medios que parecerán asombrosamente innovadores.
Nuevas fuentes potentes de energía para el futuro
Al estar aumentando en el mundo, a velocidad astronómica, el consumo de energía, el hombre está forzando en exceso las fuentes de combustibles orgánicos de que hoy en día depende tanto, carbón, petróleo, madera, desperdicios agrícolas. Sólo durante el siglo pasado el consumo de estos combustibles fue casi la mitad del total utilizado en los 19 siglos precedentes; actualmente se espera que el consumo doble y luego vuelva a doblar antes del año 2000.

ALIMENTANDO UN FUEGO A 60° BAJO CERO. Un científico observa tras un cristal cómo se ensaya un combustible experimental para cohetes. La cámara se enfría a 60 °C bajo cero, que es la temperatura a alturas de 1.000 metros y superiores. En el motor de un cohete, el combustible tiene que inflamarse instantáneamente, ya que de lo contrario las volátiles partículas del combustible sin inflamar podrían acumularse.
Se buscan por todo el mundo nuevas reservas. Aún más importante es la búsqueda de fuentes de energía completamente diferentes, que serán necesarias para mantener las crecientes poblaciones y la compleja técnica del mañana. Entre los apasionantes adelantos que se esbozan en las páginas siguientes se encuentran los esfuerzos por utilizar el incansable impulso de las mareas, de la luz solar y del calor de la tierra, y controlar la esquiva energía de los «lasers», y la fusión nuclear.
Dos proyectos para utilizar la fuerza de los mares
Hacia los años 1920, y al observar el formidable empuje de las mareas en la bahía de Passamaquoddy, entre Maine y Canadá, Franklin Roosevelt se interesó por las posibilidades de utilización de la energía de las mareas para generar fuerza eléctrica.

LA MAREA ENTRA. El Proyecto Energía por Fuerza de las Mareas de Passamaquoddy creará energía gracias a un proceso de dos fases relacionado con la subida y la bajada de las mareas en lo bahía de Fundy, entre Nueva Escocia y el Canadá, según se ve en los mapas. La primera fase (arriba) consistirá en encerrar agua en la bahía de Passamaquoddy, el «Lago Alto», abriendo para ello los compuertas en (1) y (2) y dejando que entre la marea ascendente, y luego cerrando las compuertas justo antes de que la marea empiece a descender. Las diferencias en el nivel del agua entre la marea alta y la marea baja, en la bahía de Fundy, son las mayores del mundo, y van desde 5 m en Passamaquoddy hasta 15 m en la cabeza de la bahía. Los muelles se construyen altos, y los puertos se dragan, pero los barcos a veces quedan en seco cuando baja la marea (véase arriba y abajo).
La marea sube desde el mar y luego vuelve a bajar en ciclos de 12 horas, desplazando dos mil millones de toneladas de agua cada vez que sube o baja un promedio de unos cinco metros. El esquema de Roosevelt para utilizar esta fuerza fracasó en los años 1930, pero ha sido mejorado como Proyecto Energía por Fuerza de Mareas de Passamaquoddy.

La construcción costará más de mil millones de dólares y, si todo va bien, el proyecto estará produciendo energía en 1971. Eventualmente, su producción máxima diaria de un millón de kilovatios se suministrará a lugares tan distantes como Albany, Nueva York, y cubrirá fácilmente el esperado aumento de consumo anual de energía eléctrica de Nueva Inglaterra.

CANALIZANDO EL CANAL. Los cajones de hormigón del primer embalse del mundo para mareas, se extienden en forma de arco a través del río Rance, en el norte de Francia. Utilizará la fuerza de los mareas del Canal de la Mancha, los cuales suben y bajan hasta 13 metros. Una esclusa (extremo derecha) permite el acceso de la navegación al concurrido y cercano puerto de Saint Malo.
Pero cuando se complete el proyecto de Passamaquoddy, hará ya casi diez años que los franceses habrán estado utilizando las mareas. El embalse representado más abajo se extiende a través del río Rance, en la costa de Bretaña. Si bien es menos ambicioso que el de Passamaquoddy, está en camino de verse terminado en 1965.
UN TORRENTE DE ENERGÍA PARA FRANCIA. Un torrente de marea vuelve al Canal a través de uno de los aliviaderos del embalse del Rance. Cuando el embalse esté terminado, las compuertas de los aliviaderos se utilizarán para encerrar el agua en el lago. Luego, cuando baje el nivel del agua del lado del Canal, el agua del lago fluirá por las turbinas de la planta de fuerza, produciendo electricidad. |
|
Del fondo de la tierra, un penacho de energía
Ya en 1904, unos ingenieros italianos, cerca de Lardarello, en la Toscana, hallaron una manera de fabricar energía eléctrica barata, que sigue siendo una prometedora reserva de energía para el futuro. La fuente de energía es vapor que brota de pozos perforados y que se utiliza para impulsar generadores de turbina. Hoy en día las plantas de vapor de Lardarello producen dos mil millones de kilovatios hora de energía por año.
En otras regiones el vapor de la tierra se utiliza también para otros usos. En Islandia, 45.000 personas lo usan para calentar sus hogares. En Kenia, sirve para incubar polluelos. En Nueva Zelanda y en el estado de California es una fuente de energía eléctrica. El costo de instalación de una planta de vapor es elevado, pero lo que se ahorra de combustible hace que esa energía resulte relativamente barata.

UNA FUERZA QUE ESCALDA. Un rugiente chorro de vapor a 175° C oculta el sol, mientras que un trabajador con las orejas protegidas deja salir la presión de un pozo de vapor cercano a Lardarello, Italia. El vapor, que es el producto de agua superficial que ha penetrado por hendiduras volcánicas, se dirige por medio de tuberías a generadores de turbina, y a torres de condensación (al fondo).
La luz solar; fuente inmensa, pero variable, de energía
A medida que los combustibles fósiles van disminuyendo, los científicos muestran un interés creciente por una de las fuentes de combustible que más a mano están: la luz del sol. Suministrada en cantidades enormes, la luz del sol proporciona cada dos días a los EEUU una cantidad de energía igual a la de todas nuestras reservas de combustibles fósiles. Como nos llega en forma muy difusa, casi el único uso que puede hacerse de ella es para evaporación. Para convertirla en fuente de energía eficaz es preciso recogerla y concentrarla, lo cual es una operación cara. La oscuridad y el mal tiempo, por otra parte, ocasionan constantes interrupciones en la recepción de la regular emisión de energía del sol.

FABRICACIÓN DE SAL CON LUZ SOLAR. Las inmensas cubetas de la Leslie Salt Company, de San Francisco, recogen 10 centímetros de cristales de sal por año, por evaporación del agua del mar. El secado de la sal resulta poco económico, pero así se producen anualmente en EEUU un millón de toneladas.
| CONFERENCIA DE COCINEROS SOLARES. Una reunión internacional de expertos en energía solar nos muestra una diversidad de hornillos solares. Ideados en el Líbano (arriba izquierda), Indio (arriba centro), Japón (abajo derecha) y los EEUU, estos artificios consiguen temperaturas de hasta 175° C, lo suficiente para hervir un litro de agua en 15 minutos. Pueden asar, freír, o guisar a presión. |
Lejos están, pues, las aplicaciones industriales importantes de la energía del sol. Baterías solares compactas funcionan bien en los satélites espaciales, y se encuentran actualmente en una serie de aparatos de consumo actuados por la luz del sol.
| UN ARDIENTE HORNO FRANCÉS |
Una colección de aparatos solares, algunos de fantasía, otros útiles
La energía solar ha recibido mucha publicidad como combustible del futuro. Pocos de los combustibles exóticos que algún día pueden mover nuestras plantas de energía, serán nunca útiles a escala tan personal como el encendedor de la derecha. Al fin y al cabo, el sol es gratis, hecho que ha inspirado una gran colección de aparatos. Entre ellos se encuentran radios, ventiladores, automóviles, barcas, neveras, destiladores de agua dulce, calentadores para agua e incluso casas enteras (abajo).

CALEFACCIÓN CELESTIAL. Aquí el sol se refleja en el tejado cubierto de cristal de una casa solar inventada por Harry Thomason. Trozos de cristal de ventanas forrados de chapa metálica ondulada negra, actúan como colectores de sol. En los días sin sol hay que utilizar un calentador eléctrico. El inventor afirma que el ahorro de combustible compensa los gastos de instalación.
Muchas de estas invenciones adaptan principios científicos correctos. Hay una radio que funciona por un sistema semejante al del satélite Telstar.
La luz activa el paso de electrones entre dos aleaciones especiales, generando electricidad. Una nevera utiliza el calor del sol para liquidar amoníaco, el cual luego se evapora dando un gas, y extrayendo calor del interior de la nevera. La casa solar que representarnos más arriba utiliza el hecho de que el cristal deja entrar los rayos infrarrojos que transportan calor, pero no los deja salir. Así encerrada, la luz infrarroja puede calentar una casa en pleno invierno hasta temperaturas de 21° C o más.
Excesivo entusiasmo por utilizar la energía gratis del sol también ha conducido a algunas aventuras disparatadas. Así, en 1946, el Gobierno de la India contribuyó a dos fábricas para la fabricación de un hornillo solar para uso de los 300 millones de campesinos de la India. Al cabo de un año de producción, el total de ventas se elevaba a 50 hornillos.
| LUMBRE SIN CERILLAS. Un entusiasta del sol, Harry Thomason, de Washington, D. C., se da lumbre solar. Este aparatito que es una miniatura del hornillo solar, concentra la luz solar por medio de un espejo cóncavo parabólico. Tiempo necesario para encenderlo: 30 segundos. |
Por lo visto nadie se había dado cuenta de que la mujer no tenía deseos de guisar junto al hornillo, a pleno sol, ya que las temperaturas en la India a mediodía pueden llegar a 38° C.
Buscando en la fusión el combustible definitivo
El monstruo que aquí representamos es un C-Stellarator. Forma parte de un inmenso esfuerzo de los EEUU por controlar la energía de la fusión termonuclear.

EN BUSCA DEL ÉXITO EN LA FUSIÓN. El C-Stellarator de Princeton, Nuevo Jersey, que es parte del proyecto de 535 millones para dominar lo fusión, es uno de los mayores artefactos de fusión del mundo. Por su interior fluye una corriente de iones de deuterio libres, que los científicos confían en purificar y calentar para lo fusión. Abajo, a la derecha, hay uno bomba que mantiene el ultravacío.
En pocas palabras, fusión es lo que ocurre cuando dos núcleos se unen formando uno solo. Como ocurre con los átomos de deuterio (hidrógeno pesado), que se utilizan en muchos experimentos de fusión, los núcleos que se unen liberan cantidades enormes de energía. Pero para conseguir la fusión es necesario calentar el deuterio a unos 100 millones de grados. Estas condiciones cósmicas plantean un difícil problema: ¿cómo contener una sustancia tan caliente que desintegraría instantáneamente todas las sustancias físicas conocidas? La fascinadora solución sobre la que se trabaja actualmente consiste en tejer un capullo magnético invisible, pero indestructible.
| EL RESPLANDOR AZUL DEL PLASMA. En esta demostración de uno de los principios del C-Stellarator, se mantiene una corriente de electrones libres y núcleos atómicos, llamada plasma, en el interior de un campo magnético creado por un alambre electrificado. Las partes azules al exterior de la bobina de alambre indican que no todas las partículas están confinadas por el campo magnético. |
Si se llegase a resolver este formidable problema, el deuterio en el agua del mar nos podría proporcionar mil millones de veces la energía que ahora queda en todas nuestras reservas de carbón y petróleo.
Un rayo de largo alcance: el laser
La última y más precoz de las fuentes de energía es el rayo laser, forma de luz muy especial, que la ciencia puede utilizar de un número asombroso de maneras. Lo que hace que la luz laser sea tan poco corriente es el hecho de que todas las ondas de luz del haz son coherentes, o sea de exactamente la misma longitud de onda (abajo, enfrente). En consecuencia, las ondas de luz pueden avanzar kilómetros en línea sin separarse apreciablemente. Por otra parte, el haz corriente de un proyector se difunde al cabo de pocos metros porque sus ondas luminosas son de frecuencias diversas, se interfieren y se dispersan.
La coherencia del rayo laser ha sugerido su uso para el transporte de enormes impulsos de fuerza que no disminuirían a lo largo de grandes distancias. La idea consiste en convertir la energía eléctrica en luz laser, e invertir el proceso al extremo receptor.
Sobre la tierra, donde la lluvia o la niebla interferirían con la transmisión, habría que transmitir los láseres a través de tuberías al vacío, para evitar pérdidas de fuerza.
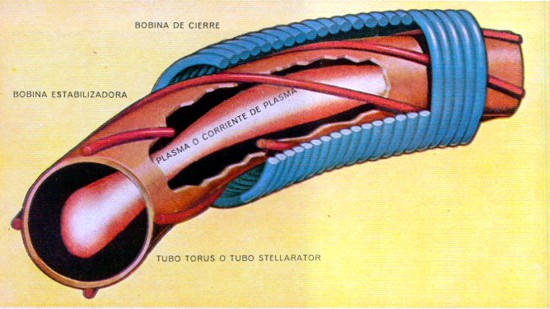
CÓMO HILAR UN CAPULLO MAGNÉTICO. Este dibujo en sección muestra dos tipos distintos de arrollamiento de olambre que mantienen el plasmo centrado en el tubo «torus» del C-Stellarator. El carrete azul suministra un campo magnético básico para encerrar el plasma; el rojo proporciona un campo suplementario que evita que las partículas del ferro del torus se mezclen y contaminen el plasma.
Tales tuberías deberían ser perfectamente rectas, para que encajase en ellas el rayo laser.
La luz laser es única por otra razón: es de longitud de onda ultracorta. A diferencia de las ondas de radio, que se miden por cientos de metros, y de las ondas de televisión, que se miden por centímetros, las longitudes de onda de los laser se miden en décimas de millonésima de centímetro. Esto abre la posibilidad de utilizar el laser como transmisor de comunicaciones capaz de llevar un gran volumen de mensajes sobre una banda muy estrecha de frecuencias.

UNA MEJORA. Un importante descubrimiento en la busca de maneras de variar las frecuencias de los rayos laser fue la de que un cristal de fosfato mono-amónico dobla la frecuencia de un rayo laser rubí, cambiando su color de rojo a luz ultravioleta, que la película «ve» como azul. Los rayos pasan a través de humo para que sus colores característicos sean visibles.
Tiene también una ventaja militar definitiva; a fin de evitar la intercepción por el enemigo, podría enviarse señales a satélites situados en el espacio, en un haz laser más fino que un cabello.
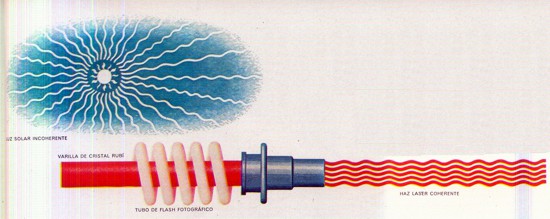

PARA QUE EL RUMBO NO VARÍE. Un extraño instrumento, el «toser anular» permite confiar en que se conseguirá una exactitud absoluto en los sistemas de dirección de naves y de vehículos espaciales. Dos haces laser son de frecuencias idénticas. Variaciones en la posición de la nave causarían pequeñas variaciones, las cuales podrían activar artificios que corrigiesen su curso.

Entre una cascada de chispas de metal ardiente, un intenso rayo laser, a 5.500° C se abre paso a través de una hoja de afeitar. Este poder destructor puede ser controlado con precisión exquisita; el uso de lasers en cirugía óptica y para microsoldadura es algo inminente.
F I N
Apéndice
Reservas de energía: depósitos de fuerza para el futuro
En la tabla que sigue indicamos el cálculo de las reservas humanas de las principales fuentes de energía: carbón, petróleo y gas natural (combustibles fósiles), energía eléctrica y combustibles nucleares (óxidos de uranio y de torio).
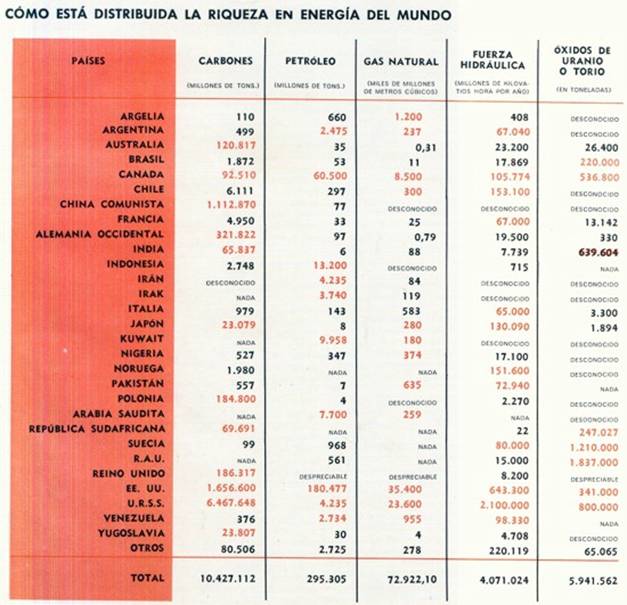
En la lista se incluyen los principales países con las reservas más importantes de cada categoría en anaranjado. Estos datos son necesariamente incompletos; algunos países no publican datos al día, y otros no han explorado totalmente sus reservas; además, tal vez se descubran nuevos depósitos.
Historia del desarrollo de la energía atómica
Ningún acontecimiento de este siglo XX ha tenido consecuencias tan sensacionales como la liberación de energía del núcleo atómico.

UNA CARTA QUE PUSO EN GUARDIA A UNA NACIÓN. A la famosa carta del doctor Albert Einstein el presidente Roosevelt se ha atribuido la bomba atómica. Un grupo de científicos que trabajaban en los Estados Unidos se sintió alarmado por la investigación atómica que se llevaba a cabo en Alemania, y convencieron a Einstein para que fuese utilizado su nombre. Pocos meses más tarde se concedió una subvención al proyecto bajo el cual se construyó el primer reactor nuclear.
Desde el descubrimiento de la radiactividad en 1896, la acumulación de conocimientos experimentales y teóricos sobre el átomo ha ocupado el apasionado interés de una lista brillante de científicos. Un programa acelerado de investigación, dirigido por los hombres que mostramos enfrente, produjo la bomba atómica. La cronología que sigue indica los pasos que condujeron a aquel acontecimiento y el progreso realizado desde entonces.
1896 | El físico francés Henry Becquerel descubre la radiactividad cuando sus placas fotográficas resultan veladas por el uranio. 1898 Estimulados por Becquerel, los físicos Marie y Pierre Curie inician en París unos trabajos que culminan en el descubrimiento de un nuevo elemento, el radio. |
1902 | El físico británico Ernest Rutherford y el químico Frederick Soddy explican la desintegración radiactiva, en la que elementos como el radio se convierten en otros, liberando energía. 1905 Albert Einstein, un empleado de patentes en Berna, muestra la equivalencia de masa y .energía en la ecuación E = mc2, como parte de su Teoría Especial de la Relatividad. Esta ecuación predice que en la materia se encuentran inmensas cantidades de energía. |
1910 | Soddy anuncia la existencia de isótopos, formas de elementos que tienen las mismas propiedades químicas, pero diferentes pesos atómicos |
1911 | Rutherford, utilizando partículas alfa, investiga el interior del átomo, descubriendo su pesado núcleo. |
1913 |
|
1919 | Rutherford comprueba la desintegración del nitrógeno en oxígeno e hidrógeno al ser bombardeado con partículas alfa. Ésta es la primera reacción nuclear observada por el hombre. |
1928 | Dando los primeros pasos hacia la comprensión fundamental de las fuerzas nucleares, los americanos Edward Condon y Ronald Gurney, y el ruso George Gamow, independientemente, explican cómo se emiten las partículas alfa. |
1931 | El químico americano Harold Urey descubre el deuterio, isótopo pesado del hidrógeno, utilizado en la primera bomba-H. |
1932 |
|
1933 | Iréne y Frédéric Joliot-Curie, físicos franceses, probaron que algunos átomos normalmente estables experimentan reacciones nucleares al ser bombardeados con partículas alfa, y se convierten en isótopos inestables. Fue la primera radiactividad creada artificialmente. |
1938 | Hans Bethe, en los Estados Unidos, propone la teoría de que la energía solar procede de la reacción de fusión, proceso en el cual dos núcleos ligeros se juntan y liberan grandes cantidades de energía. Es la reacción que produce la explosión de la bomba-H. |
1939 |
|
1940 |
|
1942 |
|
1943 | En Hanford, Washington, se construyen reactores para la producción de plutonio. |
1945 |
|
1949 | La U.R.S.S. hace estallar una bomba atómica. |
1950 | El 31 de enero, el presidente Harry S. Truman anuncia que ha autorizado a la Comisión de Energía Atómica (AEC) a proseguir el desarrollo de la bomba-H. |
1952 | La primera bomba atómica británica estalla el 3 de octubre, en la isla Monte Bello, junto a Australia. |
1953 | En agosto, la U.R.S.S. hace estallar una bomba-H. |
1954 | Botadura del Nautilus, primer submarino atómico de EE. UU. |
1956 | Comienza a funcionar el primer reactor para la producción de energía eléctrica en Calder Hall, Inglaterra. |
1957 | El reactor de Shippingport, primera planta atómica para la producción de energía eléctrica, se inaugura en los EEUU. |
1959 | En Nevada se prueba por vez primera un pequeño reactor atómico, kiwi-A, para propulsión de cohetes |
1960 | Francia hace estallar una bomba atómica en el Sahara. |
1961 |
|
1962 |
|

ARTHUR H. COMPTON. Físico ganador de un Premio Nobel. Compton fue administrador de un proyecto para fabricar plutonio para uso en la bomba atómica. ENRICO FERMI. Otro ganador del Premio Nobel. Fermi dejó lo Italia de Mussolini en 1938, y fue director del equipo que construyó el primer reactor nuclear. LESLIE R. GROVES. Procedía de la Academia de West Point. Como general de división fue el jefe del «Manhattan Engineer District», que fabricó la bomba-A.

ERNEST O. LAWRENCE. Jefe del famoso Laboratorio de Radiación de la Universidad de California; ganó el Premio Nobel gracias a inventar el inestimable Ciclotrón. J. ROBERT OPPENHEIMER. Desde 1943 a 1945 Oppenheimer dirigió los Laboratorios Científicos de Los Álamos, donde se realizó el diseño de la bomba atómica. GLENN T. SEABORG. Seaborg ganó un Premio Nobel por la fabricación de elementos tales como el plutonio. Jefe de la Comisión de Energía Atómica en 1961.