
Los diamantes son preparados por los químicos
B. Deriaguin y D. Fedoseev
... Mayo de 1973. En la sesión del Presidium de la Academia de Ciencias de la URSS los asistentes escuchaban con gran interés el informe acerca de la síntesis del diamante. Al final de dicho informe se demostró un anillo adornado con diamantes sintéticos. Éstos fueron preparados por los químicos de Kíev.
“Cerca de cinco mil años atrás el mundo conoció el diamante, y aproximadamente cinco mil años el hombre se apasionaba por la hermosura y brillantez de esta magnífica piedra, abriendo las maravillosas páginas de su vida...”
Escribía sobre el diamante el excelente conocedor de la piedra, el académico E. A. Fersman.
Los diamantes artificiales de Kíev representan una de las páginas de la nueva historia de este extraordinario mineral, que comenzó y continua creando el hombre.
Esta página se abrió casi tres siglos atrás, cuando el químico francés Lavoisier contó a los hombres sobre la relación del diamante con el carbono. Al final del siglo XVII comenzaron las incansables tentativas del hombre de obtener por vía artificial la enigmática variedad del carbono cristalino. La historia de esta búsqueda está enriquecida de famosos nombres. Lundblood, Hall, Hannay, Karazin, Moissan, Vereschaguin, Jrutshev y muchos otros científicos rusos y extranjeros aportaron su enorme óbolo en el conocimiento de la naturaleza del diamante y los caminos de su preparación.
En la actualidad los diamantes artificiales industriales (utilizados en la industria) no es una novedad. Ellos sirven lealmente a los hombres acrecentando los logros del progreso científico-técnico.

Diamante (arriba) y cuarzo (abajo). El "viso" del diamante depende de fuerte refracción de los rayos en el cristal. Al pasar por el diamante ellos divergen en abanico. Esto es precisamente la dispersión.
Los científicos de muchos países trabajan hoy día en la tecnología de obtención de grandes diamantes, y muy pronto ellos serán preparados rápida y fiablemente.
Pero antes de llegar ese momento, en la historia del diamante artificial sucederá no un solo acontecimiento. A los investigadores les espera un trabajo laborioso en el perfeccionamiento de los métodos ya existentes de sintetización del diamante, tales como el método de altas presiones o de acrecencia y formación del cristal del gas, y también la elaboración de métodos nuevos, basados en los últimos logros de las distintas ramas de la ciencia.
En este libro hemos pretendido relatar acerca de cómo la colaboración de los químicos y físicos ayudó al hombre a obtener el diamante artificial, o sea, un material, en el cual en el pasado se podía solamente soñar.
Capítulo 1
El rey de los minerales
El diamante es una piedra preciosa Se considera con derecho uno de los minerales más caros. Incluso los diamantes más minúsculos valen centenas de veces más caro que pedacitos de platino y oro equivalentes por su peso; los diamantes grandes son simplemente inapreciables en comparación con otras piedras preciosas. Los joyeros tallando el diamante preparan de él un brillante, que se distingue por su maravillosa propiedad de transformar el rayo de luz en un arco iris alegre. Con el menor movimiento la piedra centellea e irisa, es decir, hace visos con los tonos variados de los admirables matices.
Como es sabido, el rayo de luz está compuesto por rayos de distinto color. Ellos componen el espectro, en el cual los rayos extremos son el rojo y el violeta. Al pasar a través de distintos materiales transparentes, el rayo luminoso se refracta de distinta manera, con la particularidad de que a cada color le es propio un carácter determinado de refracción.
El material que deja pasar los rayos se caracteriza por los índices de refracción y la diferencia de los índices de refracción de los rayos rojo y violeta. La diferencia de los índices de refracción de los rayos rojo y violeta determina la dispersión del material. El viso del cristal de diamante se explica por los altos índices de refracción y la alta dispersión. El rayo de luz blanca, al refractarse en el diamante, proporciona un haz de rayos espectrales más ampliamente divergente y por eso irisa con todos los colores del arco iris.
Los tesoros del Fondo de Diamantes de la URSS.

1. El diamante "Orlov” (189,62 quilates o 37,927 gramos) empotrado en un cetro, siglo XVI.
Por su transparencia los diamantes se dividen en varias categorías. En los cristales más transparentes los defectos no se observan incluso con ayuda de una lupa de décuplo aumento; estos diamantes son impecables. Los cristales menos transparentes son aquellos cuyos defectos se pueden revelar a simple vista. No obstante, incluso el cristal de diamante más puro (a éste se le llama diamante de puras aguas) contiene distintas inclusiones e impurezas. La absorción de los rayos de una u otra sección del espectro por el cristal depende precisamente de la presencia de dichas inclusiones e impurezas.

2. El diamante "Sha" (88,7 quilates), siglo XVII. Tiene un gran valor histórico, artístico y material.
Esto, a su vez, influye también en los efectos cromáticos del diamante.
Habitualmente el más caro se considera el diamante incoloro. Sin embargo, en la naturaleza existen cristales de diamante de tonos puros brillantes de los colores rojo, verde, azul celeste y anaranjado. Por sus propiedades estas piedras se estiman aún más.
El valor del cristal depende no sólo de su transparencia y color, sino que también de su talla, calidad de pulido y forma del diamante preparado. Con más frecuencia se encuentran las tallas “rosa”, “marqués", "brillante”, en forma de pera. La talla en brillante es la más encantadora: la piedra adquiere el máximo brillo, un maravilloso viso y una “luz” admirable. Esto se logra, dándole al diamante una forma con 58 caras, la disposición de las cuales se determina con exactitud geométrica.
El precio del diamante se determina también por su peso: cuanto mayor es la piedra, tanto más alto es su precio. El peso del diamante se mide en unidades especiales, quilates (0,2 g). En los tiempos antiguos en calidad de una de las medidas se utilizaban las semillas del algarrobo (ceratonia siligna), que en el idioma griego suena “kerátton”. De aquí proviene el nombre de “quilate”. Los diamantes más grandes alcanzan 200 quilates y más. Los más conocidos entre ellos son los diamantes “Esperanza”, “Orlov”, “Koh-i-noor”, “Gran Mogol”, “Sha”.
La extraordinaria hermosura del diamante se hizo la causa de su complicada historia. En el curso de muchos siglos a la excepcional piedra se le atribuían distintas propiedades mágicas: se consideraba que ella acarreaba suerte, dicha, que conservaba la lealtad y el amor eterno, que daba audacia e infundía miedo. Los diamantes sobre todo grandes se hacían los símbolos del poder y riqueza. En su historia abundan acontecimientos inverosímiles, robos y fraudulencias. Cada una de las piedras grandes tiene su vida polifacética. Así, el diamante “Koh-i-noor”, que resplandece hoy día en la corona de la reina inglesa, en el siglo XIX pertenecía al Sha de Afganistán, Shudjha. Para mantener en sus manos esa gran joya, el Sha recurrió incluso a torturas, pero a pesar de todo perdió la piedra. El brillante “Esperanza” acarreaba desgracia a todos sus poseedores, comenzando por Luis XIV y terminando por la americana Evelyn Walsh. Las leyendas relatan sobre muchísimos asesinatos, conjuraciones y catástrofes, relacionadas con este hermosísimo cristal.
Composición y estructura del diamante. Estos cristales legendarios, así como todos los diamantes en general, se componen de carbono, el cual está muy difundido en la naturaleza. De los átomos de carbono se forma también el grafito y el carbón de piedra, con la particularidad de que por su número de átomos las moléculas de grafito y de carbón de piedra no se diferencian de la molécula del diamante incoloro. Este diamante representa carbono puro, y el colorido del cristal se debe a las impurezas.
El hombre no comprendió inmediatamente que el diamante es una de las formas del carbono. Este descubrimiento fue resultado de las investigaciones de muchos años del diamante por los científicos. Al principio, a fines del siglo XVII, Isaac Newton, al estudiar la refracción de la luz por las sustancias orgánicas, expresó la audaz hipótesis sobre la naturaleza orgánica del diamante; luego, en 1772, el conocido químico francés Antoine-Laurent Lavoisier investigó el efecto de la radiación solar, concentrada con ayuda de una lente gigante, sobre el diamante. Él descubrió que el diamante se quema en el aire, y los productos de la reacción provocan el mismo enturbiamiento del agua de cal que el gas carbónico. El químico inglés Smithson Teunant fue más lejos. Calentando en un vaso de oro con salitre, herméticamente cerrado, iguales porciones pesadas de carbón, grafito y diamante, él estableció en el año 1797 que se forman iguales cantidades de “aire combinado’'. Los ingleses Humphry Davy y Michael Faraday se convencieron definitivamente de la identidad del diamante al carbono.
En el año 1814, con ayuda de un espejo ustorio y el sol, ellos quemaban diamante y grafito, minuciosamente pesados, en oxígeno puro, midiendo anticipadamente su cantidad en el matraz de reacción. Los investigadores demostraron evidentemente que después de la incineración del diamante se forma sólo ácido carbónico, y nada más.
La breve historia del estudio de la naturaleza del diamante finalizó en 1913, cuando el padre e hijo Bragg obtuvieron el roentgenograma del diamante y establecieron su estructura interior, es decir, la disposición de los átomos en su red cristalina.
Precisamente con la estructura cristalina del diamante están relacionadas sus extraordinarias cualidades ópticas, sus propiedades físicas y químicas únicas. La célula completa mínima del diamante tiene una red cúbica que contiene 18 átomos de carbono, 8 de los cuales están situados en los vértices del cubo, 6 en el centro de sus caras, 4 en los centros de cuatro (de los ocho) cubos, formados por la división de la célula elemental con tres planos mutuamente perpendiculares. La constante de la red cristalina del diamante (la distancia, en la cual se repite completamente la estructura) constituye 3,657 Å (Å = 10-10 m = 1 Angstrom), y la distancia más corta entre los átomos es igual a 1,54 Å. Cada átomo de carbono en la red del diamante tiene cuatro vecinos equivalentes, dispuestos bajo un ángulo de 109º 30' uno con respecto a otro. En el diamante, cada uno de los cuatro electrones de valencia forma un enlace covalente con uno de los electrones del átomo vecino. El enlace covalente se caracteriza por su alta resistencia. De los elementos de la estructura cristalina del diamante se construyen los cristales, que ordinariamente tienen forma de octaedro, rombododecaedro, hexaicosaedro, cubo, y a veces se encuentran las combinaciones de estas figuras.
El diamante se compone de carbono puro. Pero este último puede formar también otra red cristalina con otro tipo de enlaces de los átomos en los cristales, formando una nueva sustancia, que se diferencia totalmente por sus propiedades del diamante, el grafito.
El grafito tiene una estructura lamelar complicada con una distancia entre las capas igual a 3,39 Å. Los átomos en la capa forman hexágonos regulares con un lado igual a 1,42 Å.
La orientación mutua de las capas es tal, que tres vértices de los hexágonos de una capa se encuentran bajo el centro de los hexágonos de la otra. Por esta razón, la repetición completa de la estructura del grafito es igual a la distancia duplicada entre las capas.
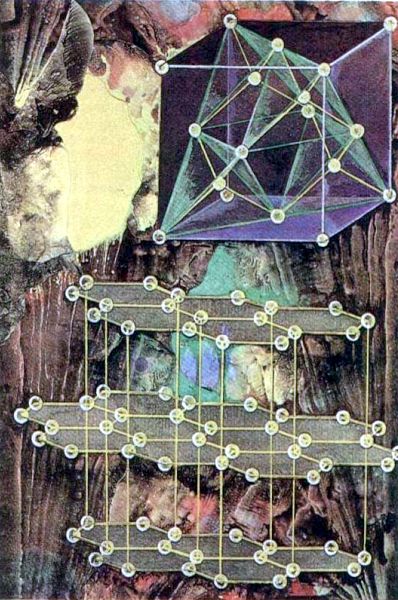
Red cristalina del diamante (arriba) y del grafito (abajo) Con la red cristalina del diamante están ligadas sus extraordinarias propiedades.
Gracias a su estructura lamelar el grafito se desintegra fácilmente en escamas, pero en la propia capa los átomos de carbono están enlazados unos con otros incluso más sólidamente que en el diamante.
El diamante obtuvo sus propiedades únicas como resultado de las condiciones singulares en las que él se formó millones de años atrás. La enorme temperatura y la alta presión en las entrañas de la Tierra les obligaron a los átomos de carbono a formarse en redes cúbicas regulares, que le atribuyen al mineral una dureza insuperable.
§. El diamante es el patrón de dureza
El diamante es valioso no sólo por sus extraordinarias propiedades ópticas, las cuales las poseen en parte también otros minerales, por ejemplo, el circón. El cristal de diamante atrae a los científicos e ingenieros por su alta resistencia mecánica.
La resistencia mecánica del cristal se determina por la dureza: por la resistencia a la indentación o al rayado con otro objeto. La dureza puede ser medida por distintos métodos. Cada método tiene su escala de dureza y su distribución de los cristales en esta escala. El diamante en cualquier escala resulta ser el patrón de dureza.
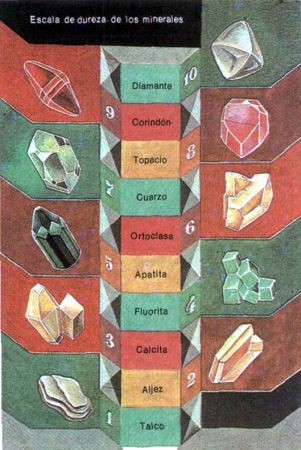
En el año 1811 el minerólogo alemán F. Mohs propuso su escala de dureza. La escala de Mohs es hoy día una de las más conocidas. Ella se basa en el hecho de que el material más duro deja rayas en el más blando. En calidad de materiales patrones para la escala Mohs tomó 10 minerales: el más blando es el talco y el más duro, el diamante.
| Dureza | Mineral | Dureza | Mineral |
| 1 | talco | 6 | ortoclasa |
| 2 | aljez (yeso) | 7 | cuarzo |
| 3 | calcio | 8 | topacio |
| 4 | fluorita | 9 | corindón |
| 5 | la apatita | 10 | diamante |
Cualquier otro mineral (o en general cualquier cuerpo sólido; por ejemplo, el vidrio, metal y otros) se puede colocar en la escala entre dos minerales, uno de los cuales raya el cuerpo dado y el otro, al contrario, es rayado por él. Sin embargo, este método no es muy cómodo: aquí depende mucho de la forma de los cuerpos y minerales y del método de producir el rayado. Además, la dureza de las distintas caras de un mismo cristal es diferente. Por ejemplo, en el diamante la mayor dureza la tiene la cara del octaedro, la menor, la cara del cubo.
Se conoce también otro método de determinación de la dureza. En la superficie pulida del cuerpo a investigar se hace penetrar con una fuerza constante una pirámide de cuatro caras de diamante. Cuanto menor es el área del hoyo que se forma, tanto más alta es la dureza de la muestra experimental. Para obtener el índice numérico de su dureza, la fuerza (en kg), con la cual se hizo penetrar la pirámide, se divide por el área del hoyo obtenido (en mm2).
Este índice (en kg/mm2) varía algo en dependencia de la fuerza de presión de la pirámide de diamante. Dicho índice resulta sobre todo considerablemente modificado en los cuerpos con distintas propiedades por toda la profundidad.
Por ejemplo, el vidrio, templado mediante el rápido enfriamiento de la masa fundida, tiene una capa superficial más compacta: ella se enfrió, se comprimió y endureció en primer lugar, mientras que las partes interiores, encerradas en la “corteza" que se forma, conservaron el estado de menor densidad. En estos casos es más cómodo medir la dureza para una pequeña penetración de la pirámide de diamante. En lo que se refiere al área del hoyo, ella se mide con ayuda de un microscopio de fuerte aumento.
Los científicos del Instituto de Estudio de Máquinas y Mecanismos de la Academia de Ciencias de la URSS M. M. Jruschev y E. S. Berkóvich elaboraron aparatos especiales para medir esta microdureza.
El nuevo método proporcionó unos resultados interesantes. Fueron medidos los índices de dureza para el cuarzo, 1100 g/mm2, el topacio, 1400, el corindón, 2100, y el diamante, 10000 kg/mm2.
Como se puede apreciar, también aquí el diamante es el patrón de dureza. Según la nueva escala, en particular, es fácil caracterizar cuantitativamente la dureza de los cuerpos, los cuales, conforme a este índice, deben situarse entre el diamante y el corindón.
El diamante es frágil. La dureza de la sustancia es la medida de su estabilidad. No obstante, pese a que posee una alta resistencia mecánica, el diamante se considera como un material frágil. Se destruye a causa de los golpes y, por eso, tiene una solidez no muy alta.
Los hombres durante largo tiempo confundían estas dos propiedades importantes del rey de los minerales: la dureza y la solidez. Tampoco se salvó de esto el famoso poeta y filósofo de la Roma antigua Lucrecio Caro. En su poema “De rerum natura” (Sobre la naturaleza de las cosas) él escribía que entre las cosas endurecidas y densas el primer lugar lo ocuparían los diamantes que no temen absolutamente los golpes, y luego seguirían el duro sílex y el hierro de potente solidez, así como el estable cobre...
Lucrecio estaba equivocado: ¡los diamantes temen los golpes! Precisamente esta propiedad -la fragilidad- impide la utilización de los cristales de diamante en las cuchillas para elaborar superficies que tienen orificios o cavidades. Esta cuchilla experimenta golpes contra las paredes de los orificios.
§. El diamante es químicamente estable.
Él posee una gran resistencia química. El diamante no se disuelve incluso al hervirlo en los ácidos sulfúrico, nítrico e hidrofluórico o en sus mezclas, que actúan destructivamente en otros minerales. Para él tampoco es peligroso el ácido dórico hirviente, que disuelve fácilmente el grafito. El diamante se oxida lentamente en los fundidos de álcalis y es más estable que el grafito durante la oxidación con oxígeno. Sobre el diamante no actúan ni las moléculas ni los átomos de hidrógeno, mientras que el grafito se transforma fácilmente en gas al interaccionar con los átomos de hidrógeno.
El diamante soporta sin acceso de oxígeno un calentamiento de hasta 2000 ºC. Sin embargo, en un medio, en el que está presente el oxígeno, a una temperatura superior a 1500 ºC, el diamante se oxida con facilidad y se transforma en grafito.
Esta propiedad del diamante limita la velocidad de elaboración de los materiales con una herramienta de diamante, puesto que a grandes velocidades el diamante se calienta debido al rozamiento y se oxida con el oxígeno del aire: sucede el desgaste químico del diamante.
Si antes la dureza mecánica y la estabilidad química del cristal de diamante se apreciaban sólo en el arte de joyería, con el comienzo de la utilización industrial del diamante, ellas desempeñan un papel particular. Siendo el cuerpo más duro, el diamante se emplea no sólo para determinar la dureza de otros cuerpos, sino también para el tratamiento de los materiales por corte, taladrado, rectificado en desbaste y de acabado, pulido.
Para la aplicación del diamante en algunas orientaciones técnicas nuevas tienen gran importancia también otras de sus propiedades únicas, tales como la extraordinariamente alta conductibilidad térmica en combinación con la alta resistencia eléctrica. Por ejemplo, los diamantes, a temperaturas superiores a 100º (por la escala de Kelvin) poseen una conductibilidad térmica más alta que incluso la plata y el cobre, con la particularidad de que el coeficiente de dilatación térmica es muy pequeño. Gracias a esto el diamante no teme los bruscos calentamientos con las fuentes exteriores de calor.
El diamante es un excelente aislador, por lo cual es muy necesario en la microelectrónica. Es suficiente transmitir a algunas secciones de la superficie del diamante propiedades de semiconductores, y pueden ser utilizadas para obtener microesquemas. Los cristales de diamante encuentran también otra aplicación en el campo de la radioelectrónica.
De este modo, el diamante, continuando su historia de muchos siglos de una piedra valiosa más hermosa, adquiere distintas especialidades.
¿Cuáles son las profesiones del diamante?
Capítulo 2
Las profesiones del diamante
§. El diamante obrero
Los diamantes naturales pueden ser de distinta calidad. De aquellos que pueden ser útiles para el tratamiento de joyería se fabrican brillantes. Los diamantes naturales de peor calidad se consideran ya industriales y se aplican ampliamente en la industria. A los diamantes industriales pertenecen aproximadamente 2/3 de los diamantes extraídos en la naturaleza.
El diamante se utiliza desde hace mucho tiempo para elaborar los materiales duros. Por ejemplo, en la India en la antigüedad estaban ampliamente difundidas las herramientas con puntas de diamante, en particular cuchillos con filo de diamante. En China estas herramientas se utilizaban para elaborar la nefrita. Existe la opinión de que 6 mil años atrás las herramientas de diamante fueron utilizadas por los egipcios en la construcción de las pirámides. Con ayuda del diamante desde tiempos inmemoriales se rectifica, pule, taladra y corta distintos materiales duros, los cuales es imposible elaborar con ayuda de otros medios.
En la industria moderna casi no existen artículos que de una manera u otra no hayan sido tocados por el diamante, sobre todo en aquellas operaciones cuando se requiere una alta calidad de elaboración, por ejemplo, la elaboración muy precisa de las pequeñas piezas de reloj. Las piezas labradas con ayuda del diamante, frecuentemente no necesitan el ulterior pulido. Los diamantes naturales se utilizan también para fabricar herramientas que trabajan en condiciones muy duras, por ejemplo, en las coronas y los trépanos de sondeo. La herramienta de sondeo de diamante cumple excelentemente el trabajo, en el que ninguna otra herramienta soportaría incluso un tiempo muy breve. Así, por ejemplo, ella se portó excelentemente en la perforación de rocas cristalinas antiguas del pozo superprofundo de Kolski. La dureza del diamante se utiliza en las empresas de labrado de los metales, en las canteras y en la industria de cerámica, en las fábricas productoras de hormigón armado y de vidrio. Incluso es imposible enumerar todas las profesiones del diamante.
El diamante pertenece a los materiales abrasivos. Los materiales abrasivos se preparan de sustancias que poseen alta dureza, resistencia y resistencia al desgaste, las partículas de las cuales son útiles para el labrado de las piezas por rasguñadura y frote. Además del diamante a los materiales abrasivos pertenecen, por ejemplo, el nitruro cúbico de boro, el corindón, el esmeril y el carburo de silicio. De los materiales abrasivos se preparan polvos que se utilizan para el labrado tanto en estado libre, como también en estado combinado en forma de herramienta abrasiva.
Se llaman abrasivas las herramientas en las cuales un gran número de granos, por ejemplo, de diamante, está fijado con el correspondiente aglutinante. Cada grano es un elemento cortante, y en la herramienta abrasiva ellos son muchos, lo que garantiza a la herramienta una alta capacidad de trabajo. Incluso si se embota un grano o se desprende éste del aglutinante, los que quedan continúan su trabajo. El aglutinante es siempre mucho más blando que los granos abrasivos, y sin ellos se desgastaría instantáneamente, pero la inmensidad de granos de diamante le protegen del frote. Una condición muy importante para la alta capacidad de trabajo de la herramienta abrasiva de diamante es la unión compacta del aglutinante con el grano de diamante. Si no existe esta unión, el grano se desprende fácilmente, prácticamente sin comenzar a trabajar. Con el fin de que esto no suceda, sobre la superficie de los diamantes se aplican distintas capas transitorias, el objetivo de las cuales es unir más fiablemente el diamante con el aglutinante, aumentando la adherencia entre ellos.
En la herramienta de diamante, en dependencia de su destinación, se emplean distintos aglutinantes. El aglutinante de volcanita a base de caucho sintético con distintas adiciones está destinado para la fabricación de discos elásticos finos, que se emplean en las operaciones de acabado. El aglutinante de cerámica (arcilla refractaria, feldespato, cuarzo y otros componentes) se utiliza en todos los casos cuando no tiene importancia su elevada fragilidad y no existen golpes. Con aglutinante de baquelita a base de resinas de formaldehido se fabrican herramientas predestinadas para trabajar en condiciones de temperaturas relativamente bajas. Las herramientas con aglutinantes metálicos son necesarias para los trabajos en condiciones particularmente duras.
La industria soviética produce cerca de 2 mil distintas dimensiones tipo de herramientas de diamante, satisfaciendo completamente las demandas de la técnica. Por ejemplo, las muelas de rectificar de diamante están destinadas para el afilado de las cuchillas de aleación dura y de acero templado, para el labrado directo de las piezas en las máquinas herramienta y líneas automáticas. Las muelas pueden ser planas de perfil directo, planas con entalla, cónicas, con perfil semicircular convexo y muchas otras. Se producen cabezales cilíndricos de diamante para el rectificado interior, limas de pelo de acero de diamante y cabezales bruñidores de diamante, sierras de recortar de diamante, cintas de diamante, lapiceros de diamante para la rectificación de los discos abrasivos. Los diamantes se utilizan en la industria y en la vida cotidiana: en las mercerías se pueden encontrar limas de diamante para las uñas.
El contenido de diamantes en los distintos artículos es diferente. Así, por ejemplo, las muelas de copa para el afilado de las cuchillas de aleaciones duras se fabrican con una concentración al 50%, al 100% y al 150% de diamantes. No se extrañen que la concentración de diamantes supera el 100%. Al fin y al cabo todo esto es convencional: por concentración al 100% de diamantes en la herramienta se ha aceptado considerar el contenido de diamantes igual a 4,4 quilates en 1 cm3 de capa diamantífera, ó 0,88 g/cm3. Esto corresponde a 27 quilates en una pulgada cúbica -relación aceptada por primera vez en los EEUU. Es fácil demostrar que para la concentración al 100% el diamante ocupa el 25% del volumen. Efectivamente, la densidad del diamante es igual a 3,52 g/cm3. Dividiendo 0,88 g/cm3 por la densidad del diamante, obtendremos 0,25. Este resultado no depende de la especie de aglutinante.
La herramienta de diamante permite aumentar la velocidad y mejorar la calidad de elaboración de los más diversos materiales, incluyendo los de perspectiva en la nueva técnica, cosa que con frecuencia es imposible realizar sin hacer uso de estos maravillosos cristales. Por esta razón, el nivel de utilización del diamante caracteriza la potencia y la eficacia del potencial industrial del país. Con relación a esto es interesante el cálculo de V. N. Bakulia, expuesto en su folleto “Diamantes; su pasado y presente”. Él caracteriza la necesidad del país en diamantes, partiendo de la cantidad de los mismos utilizada por 1 millón de toneladas de acero fundido. Conforme a los cálculos, al utilizar en el 100% la elaboración con diamante en las ramas de la industria ya asimiladas se necesitan 400 mil quilates por 1 millón de toneladas de acero fundido. En el año 1970 la fabricación mundial (sin la Unión Soviética) de acero formó 450 millones de toneladas, así que se necesitaban 180 millones de quilates de diamantes. Prácticamente se utilizaron 45 millones de quilates, es decir, el 25% de lo posible.
A propósito, ¿qué significan 450 millones de toneladas de acero y 45 millones de quilates de diamante? Imagínense un cubo de acero cuyo lado es igual a unos 400 m y un cubo de diamante con un lado menor que 1,5 m. Sus volúmenes se diferencian en más de 20 millones de veces. En la actualidad la industria produce tales camiones volquetes de gran carga, cada uno de los cuales es capaz de transportar en un viaje la producción anual de diamantes en todo el mundo.
Sobre el significado de los diamantes para la industria habla también la conclusión de los economistas norteamericanos, que consideran que sin la utilización de los diamantes el potencial industrial y militar de los EEUU, hubiera disminuido el doble. Como vemos, los diamantes son también un material estratégico.
§. El diamante investigador
Las magnificas propiedades del diamante le permiten trabajar no sólo como obrero, sino también como investigador. Es el participante permanente de los aparatos de alta precisión: los apoyos de piedra de los cronómetros de alta clase se hacen de diamante. Algunos cristales de diamante son muy sensibles a la radiación: esta propiedad se utiliza en los dosímetros de diamante.
El diamante siente excelentemente el calor y el frío. Los termómetros que funcionan a base de diamante, captan las variaciones de temperatura de milésimas partes de grado. La alta conductibilidad térmica del diamante sirvió también en las investigaciones cósmicas. Los especialistas en aeronáutica e investigación del espacio cósmico en los EEUU aplicaron el diamante para medir la temperatura de las estrellas. Un avión de propulsión a chorro eleva a las capas superiores de la atmósfera un telescopio, el cual se enfoca luego a una estrella determinada. En la trayectoria del rayo luminoso se coloca un disco fino, como una hoja de papel, de diamante. Él siente las variaciones de calor, imperceptibles con ayuda de otros medios, y las transmite a un captador especial que permite ya medir la temperatura del lejano cuerpo espacial.
Pero el servicio del diamante en el cosmos no se limita a esto. Pues el diamante es el único material que deja pasar los rayos infrarrojos, y además es capaz de soportar la baja temperatura y el vacío del espacio cósmico, y el insoportable calor y una presión cien veces mayor que la normal terrestre. Los científicos norteamericanos equiparon la sonda, que investiga la atmósfera agresiva de Venus (una temperatura de 500 ºC y una presión de 100 kgf/cm2), con una ventana de diamante. A través de esta ventana transparente pasaba la radiación infrarroja, y los aparatos pudieron investigar la atmósfera de este planeta y, en particular, precisar la composición de las nubes densas de Venus.
Al diamante investigador es mucho más joven que el diamante obrero. Pero él tiene un gran porvenir -pues el hombre, conociendo el mundo y estudiando la Tierra y el cosmos, tropieza cada vez con más frecuencia con fenómenos enigmáticos, para el conocimiento de los cuales se requieren aparatos cada vez más complicados y, principalmente, más precisos y sensibles. Tampoco aquí se puede pasar sin el rey de los minerales, el cual es ya hoy día insustituible en muchos procesos industriales y de investigación científica.
Pero, desgraciadamente, en la naturaleza este extraordinario cristal se encuentra muy raramente y su extracción resulta extraordinariamente cara. Por eso desde antaño el hombre pretende obtener el diamante por vía artificial. No obstante, antes de sintetizar el maravilloso mineral, se tuvo que iniciar el asedio duradero y fatigable de sus secretos naturales, asedio que, quizás, no se ha levantado hasta hoy día. Pretendemos comprender todos los pormenores del mecanismo natural de formación del diamante y probar a reproducir exactamente sus procesos motores en el laboratorio, y luego en la empresa industrial.
¿Qué es lo que hemos conocido acerca del diamante natural?
Capítulo 3
Los diamantes en la naturaleza
§. Yacimientos primarios
Éstos son unos de los tipos principales de yacimientos de diamante. Ordinariamente éstos son diatremas, o sea, cavidades tubulares (chimeneas) en la corteza terrestre, las cuales están llenas de roca abismal, kimberlita. Las diatremas se sitúan casi verticalmente y, además, cruzan otras rocas: las rocas antiguas cristalinas y las más jóvenes, las sedimentarias (calizas, arcillas, carbones, y otras). Estas chimeneas diamantíferas se encuentran, por ejemplo, en África del Sur y en Yakutia. Ellas, como regla, tienen sección redonda o en forma de elipse con un diámetro de decenas hasta centenas de metros. La kimberlita, que se encuentra dentro de las chimeneas, es precisamente la que contiene diamantes. El contenido de éstos rara vez es mayor de milésimas de por ciento de la masa total de roca. Los diamantes en la kimberlita están dispuestos irregularmente. En general se encuentran diseminaciones de cristal unitario, más raramente, maclas de diamante, y nunca existen grandes acumulaciones de diamantes, que se encuentran en un solo lugar.
El origen de las chimeneas diamantíferas en la actualidad está establecido casi exactamente, mientras que la formación de los propios diamantes sigue siendo un enigma. La mayoría de los científicos consideran que las chimeneas de kimberlita se formaron como resultado de la elevación del magma, rica en gases. Lo más probable es que el magma se elevaba por las grietas en las rocas, y cuando la resistencia de la capa de corteza terrestre, que quedaba hasta la superficie, se hacia menor que la presión en el magma, sucedía la explosión.
Esta teoría les da a las diatremas su denominación, chimenea volcánica.
La teoría del origen de los diamantes no existe todavía, pero existen varias hipótesis. Las principales diferencias en ellas consisten en el problema acerca de la profundidad de la formación de los diamantes y sobre la fuente de carbono, que se consume en la creación de los cristales de diamante. Está muy difundida la hipótesis del académico V. S. Sóbolev, un gran conocedor de los yacimientos de diamantes. El fue el primero quien indicó la posibilidad de la existencia de yacimientos primarios de diamantes en Siberia. Según la opinión de V. S. Sóbolev, los diamantes se cristalizan en el propio magma de kimberlita en las etapas tempranas de su desarrollo a partir del ácido carbónico que en él existe; ellos surgen a gran profundidad antes de la explosión y luego se sacan a la superficie durante el movimiento del magma y la explosión.
En los últimos años se elabora intensivamente la hipótesis de V. G. Vasíliev, V. V. Kovalski y N.V. Cherski: los diamantes se forman como resultado de la interacción del magma de kimberlita con los hidrocarburos, asociados a él en las chimeneas volcánicas. Conforme a esta hipótesis los diamantes surgen en una etapa más avanzada de formación de la chimenea diamantífera.
Existe toda una serie más de hipótesis acerca del origen de los diamantes, las cuales son discutidas actualmente por los científicos.
Las chimeneas diamantíferas fueron descubiertas en África del Sur en el año 1871 cerca del pueblo Kimberley y recibieron el nombre de kimberlita.
Antes del descubrimiento de los yacimientos de Yakutia estos tubos eran prácticamente la única manifestación de los yacimientos primarios. El 21 de agosto de 1954 el geólogo L. A. Popugáeva descubrió la primera chimenea diamantífera en la URSS llamada “Zamitsa”. Ya al año siguiente Yu. I. Jabardin y B. N. Elagin exploraron la chimenea “Mir”. A esto le siguió el descubrimiento de toda una serie más de yacimientos industriales de diamantes en Yakutia. En el año 1957, por este descubrimiento, a un grupo de geólogos se les adjudicó el Premio Lenin.
Los yacimientos primarios de diamantes del tipo kimberlita tienen importancia industrial. No obstante, existen además yacimientos primarios de pequeños diamantes del tipo de peridotita. Estos están fijados a las rocas abisales y actualmente no es racional su explotación industrial.
§. Yacimientos de aluvión
En todo el mundo la mayor cantidad de diamantes (más del 80%) se extrae de los yacimientos de aluvión. Los placeres tienen distinto origen y están relacionados con la alteración de las rocas originarias diamantíferas y el desplazamiento de los diamantes por el viento, el agua y los glaciares. En este caso puede suceder el enriquecimiento natural de los diamantes. Se han descrito casos cuando en un metro cúbico de roca se encontraron hasta mil quilates de diamantes. En los placeres frecuentemente el número de diamantes grandes y de alta calidad es mayor que en los yacimientos primarios de diamantes, por cuanto en el proceso de traslado los cristales grandes se separan de los menudos y fragmentos.
En el año 1970 en los países capitalistas y en desarrollo fueron extraídos cerca de 36 millones de quilates de diamantes, incluyendo cerca de 14 millones en Zaire, 1,5 millones en la República de Congo, cerca de 2,5 millones en Angola y más de 8 millones en la República Sudafricana y Namibia.
El método de producción capitalista está relacionado con la actitud expoliadora con respecto a las riquezas naturales de los países poco desarrollados en general y con los yacimientos de minerales valiosos en los países coloniales y en desarrollo en particular. En 1977 el corresponsal especial del diario “Pravda” V. Korovikov escribió sobre el asolamiento de las entrañas de Namibia por los monopolios internacionales: “La ocupación más beneficiosa en Namibia es la extracción de diamantes en las arenas litorales y de las antiguas terrazas marítimas. La compañía “Consolidated Diamant Nice”, una empresa filial del monopolio internacional de diamantes “De Beers”, perteneciente al conocido businessman sudafricano Harry Oppenheimer, extrae los diamantes con ayuda de una técnica potente. De las entrañas de Namibia se extraen anualmente cerca de millón y medio de quilates de cristales valiosos. Los diamantes de Namibia son famosos porque la mayor parte de la extracción son piedras de joyería. En el último informe sobre la actividad de “De Beers” en el año 1976 se exponen unas cifras muy significativas. Namibia proporcionó el 10% de toda la extracción de diamantes en las minas de la compañía, lo que produjo el 25% de todos sus beneficios. Y estos beneficios son verdaderamente fabulosos. En el año 1976, después de pagar los impuestos, formaron 337 millones de rands (cerca de 400 millones de dólares norteamericanos). Los riquísimos placeres en Namibia se explotan intensamente.

Yacimiento primario de diamantes. Chimenea de kimberlita Arriba: un meteorito incidente sobre la superficie de la Tierra En los meteoritos se descubrieron diamantes
Como resultado, una parte considerable de los placeres ya se ha agotado, y toda la zona diamantífera hacia el norte de la desembocadura del río Orange será asolada en los próximos diez o quince años”.
Placeres de diamantes pobres, que no tienen importancia industrial, existen en muchos países. Prácticamente en la Tierra por doquier se encuentran cristales separados de diamante. En la Unión Soviética se encuentran no sólo en Siberia y en los Urales, sino también en la Meseta Central Rusa y en Ucrania. A veces estos descubrimientos se relacionan con la caída de gigantes meteoritos sobre la Tierra en los tiempos prehistóricos.
La presencia de diamantes en los meteoritos fue establecida por primera vez en 1888 por los científicos rusos, los profesores del Instituto forestal de Petersburgo M.V. Erofeev y P. A. Lachinov. Ellos descubrieron diamantes en el meteorito pétreo que cayó cerca de la aldea Novi Urey (hoy día la aldea Karamzinka de la provincia de Gorki). Tales meteoritos recibieron el nombre de ureilitos.
En el año 1891 los científicos norteamericanos descubrieron diamantes en los fragmentos del meteorito que cayó en el Cañón del Diablo (EE.UU., estado Arizona). El cráter en el lugar de caída de este gigante cuerpo cósmico tiene cerca de 1200 m de diámetro y hasta 184 m de profundidad. Según la apreciación de los especialistas la masa inicial del meteorito podía ser desde 50 mil hasta 3 millones de toneladas, y su velocidad durante el choque constituía 12 a 20 km/s. El meteorito de Arizona pertenece a los férricos, y alrededor del lugar de caída los investigadores recogieron muchas toneladas de hierro meteorítico. Este se conservó ante todo merced a la superstición de los indios nativos, para los cuales el cráter y todo lo relacionado con él era sagrado.

Diamantes de los placeres.
En Europa la gente habitualmente utilizaba el hierro meteorítico, y el primer hierro empleado aquí por el hombre en la economía, era meteorítico.
Los diamantes en los meteoritos representan pequeños cristales de varios micrones de tamaño. Lo más interesante resultó el hecho de que al lado del diamante, que ordinariamente tiene una estructura cúbica, en los meteoritos descubrieron cristales de una nueva modificación hexagonal. A este cristal se le llamó lonsdalita, en honor a la conocida investigadora de la estructura de los diamantes Catlin Lonsdale.
En el meteorito del Cañón del Diablo la lonsdalita formaba cerca de la tercera parte de la cantidad total de diamantes hallados en él.
Los diamantes en los meteoritos se formaron como resultado de los choques de los meteoritos, que se mueven a velocidad enorme en el espacio cósmico, uno con otro (en lo fundamental en la zona de los asteroides) o con la Tierra. Las altas presiones y temperaturas que surgen en este caso crean condiciones favorables para la cristalización del diamante del carbono contenido en los meteoritos.
Al caer los meteoritos a la Tierra se forman hoyos, gigantes cráteres meteoríticos. En ellos pueden ser descubiertos granos de diamante turbios de forma irregular, que tienen el aspecto de pedazos. Los diamantes se formaron, indudablemente, al caer un meteorito gigante en las rocas carboníferas.
§. Clasificación de los diamantes
En distintas condiciones surgen diamantes de diferentes especies, y cada una de las variedades de diamantes puede tener su campo de aplicación. Para el discernimiento exacto y la investigación práctica correcta de una u otra especie de diamantes tiene importancia la clasificación científica argumentada de los mismos.
Al hombre al principio le interesaban sólo los diamantes grandes, de los cuales se fabricaban brillantes: estos diamantes son mundialmente conocidos, ellos son obras de arte, y se conocen por sus nombres. Pero en nuestros días, en relación con la utilización industrial del diamante, resulta cada vez más necesaria la clasificación exacta de todas sus variedades, y la creación de esta clasificación no es un problema fácil ni mucho menos. En este dominio ha realizado un gran trabajo el eminente científico soviético Yu. L. Orlov.
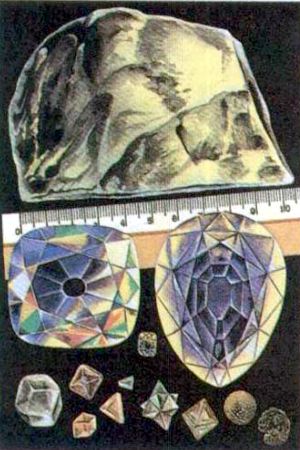
“Cullinan (3106 quilates), el diamante más grande hallado en la naturaleza. En el centro, dos de los 105 brillantes obtenidos del “Cullinan'': el "Cullinan I" (530,2 quilates), el “Cullinan II" (317,4 quilates) Para comparación entre ellos se encuentra un brillante de 1 quilate Abajo, algunas formas naturales de los diamantes.
Todos los diamantes naturales fueron divididos por él en dos grandes grupos: monocristales y policristales, formaciones policristalinas, y los grupos, en diez variedades.
A los diamantes monocristalinos, a las primeras cinco variedades- pertenecen tanto los cristales transparentes, bien tallados, como los diamantes con distintas inclusiones, coloreados y opacos.
Las formas policristalinas de diamantes son las ballas, el bort y el carbonado. Las ballas tienen estructura radial radiada y por su forma son semejantes a las esferas. El bort representa también maclas de cristales aislados de diamante. Ocupa un lugar algo especial la décima variedad, el carbonado, formaciones cristalinas menudas. El carbonado se diferencia mucho de otros diamantes y puede ser considerado no sólo como una variedad de las formaciones policristalinas del diamante, sino también como una variedad de la propia forma mineral, el diamante. El carbonado está compuesto por cristales pequeños (hasta 20 micrones) de diamante, como si estuvieran sinterizados entre sí.
La clasificación de los diamantes naturales, propuesta por Yu. L. Orlov, pertenece a la categoría de mineralógicas. La clasificación técnica de los diamantes es más detallada e incluye una gran cantidad de grupos y tipos.
Los diamantes naturales, incluso los de “puras aguas”, no son del todo puros y además de carbono contienen otras inclusiones. Claro está que la cantidad de estas inclusiones es distinta en los diamantes de distintas variedades y de diferentes yacimientos. Las principales impurezas en los diamantes suelen ser el hidrógeno, boro, nitrógeno, oxigeno, sodio, aluminio y el silicio. Prácticamente en los diamantes se pueden hallar todos los elementos de la tabla periódica de los elementos.
En este libro nosotros relataremos acerca de la obtención de diamantes artificiales, dejando aparte todo lo relacionado con las búsquedas y los descubrimientos de depósitos de diamantes, con la extracción y elaboración de los mismos. A todos aquellos que les interesen estos problemas les recomendamos el atractivo libro de T. I. Shafronovski “Diamantes”. Aquí sólo prestaremos atención al hecho extraordinario: muchos descubrimientos de diamantes naturales están relacionados con los niños. En efecto, el primer diamante en África del Sur fue hallado en el año 1867 por unos niños que jugaban con esta piedrecita brillante. Naturalmente que apareció un cazador de avestruces adulto quien les quitó esta piedrecita. El primer cristal de diamante en los Urales fue hallado en 1829 por Pavel Popov de catorce años en la mina de oro de Krestovozdvizhensk. Los primeros diamantes uralenses fueron regalados al conocido geógrafo y viajero A. Humboldt, quien en aquel tiempo viajaba por Rusia.
La gente conocía poco a poco los secretos del diamante, descubría sus propiedades, composición e yacimientos. Aparecieron conjeturas sobre las condiciones del surgimiento de este maravilloso cristal. Cuando los científicos conocieron ya mucho acerca del diamante natural, apareció la posibilidad de realizar el sueño de muchos años sobre la obtención del diamante artificial. ¿Cuál es la historia del diamante sintético?
Capítulo 4
Tres períodos en la historia de la síntesis del diamante
§. Periodo intuitivo (empírico)
Prácticamente después de que se hizo evidente que el grafito y el diamante están compuestos sólo de carbono se iniciaron inmediatamente las tentativas de sintetizar los diamantes.
El conocido hombre público ruso V. N. Karazin realizó experimentos de la combustión del carbón, pretendiendo crear el diamante. Por desgracia, no se conservaron los detalles de sus experimentos, pero lo importante es que estos experimentos se realizaban en un sentido, y como resultado en el año 1823 se obtuvieron unos cristales muy duros. La investigación de laboratorio demostró su identidad con el diamante.
En 1880 los experimentos sobre la síntesis del diamante fueron realizados por el científico inglés Hanney. En unos tubos de acero soldados herméticamente, parecidos a los cañones de artillería, él calentaba una mezcla de hidrocarburos con sales de litio y sodio. Los tubos se calentaban durante todo un día hasta el rojo, y solamente muy pocos de ellos soportaban esta dura prueba. En uno de los tubos que no explotaron Hanney descubrió más de una decena de cristales brillantes, que rayaban el corindón (el siguiente mineral después del diamante por su dureza), tenían una densidad de cerca de 3,5 g/cm3 se quemaban sin residuo en la llama de un quemador y no se disolvían en ácido hidrofluórico.
Obtuvieron fama mundial los experimentos del científico francés Henri Moissan, quien empleó ampliamente en sus investigaciones el horno eléctrico inventado por él mismo. Moissan disolvía en hierro hirviente carbono puro, carbón de azúcar, y vertía esta solución en agua fría. El científico razonaba aproximadamente así: en estado caliente el hierro disuelve considerablemente mayor cantidad de carbono que en frío, por eso, al enfriarse, el carbono excesivo debe desprenderse en estado libre en forma de grafito y, posiblemente, en forma de diamante. El hierro, además, a diferencia de la mayoría de los metales, al enfriarse, no disminuye de volumen, sino que aumenta. La costra superior que se enfría inmediatamente durante el enfriamiento impedirá la expansión de las capas interiores, las comprimirá y conducirá a un aumento considerable de la presión. Pero para que el grafito se transforme en diamante, se requieren precisamente altas presiones, pues el grafito está menos compactamente constituido por los átomos de carbono que el diamante. De este modo, según la idea de Moissan, se creaban las condiciones favorables para la cristalización del diamante.
Un lingote de hierro colado (la disolución del carbono en el hierro conduce a la formación de hierro colado) se disolvía durante largo tiempo en distintos ácidos, y como resultado Moissan separó varios granos, principalmente de color negro. Estos granos rayaban el corindón, se quemaban casi completamente en oxígeno, tenían una densidad superior a 3 g/cm3. El científico comunicó sobre sus experimentos en el año 1899.
En este mismo año, el profesor de la Academia de Medicina Militar de Petersburgo K. D. Jruschev en la sesión de la Asociación mineralógica de San Petersburgo hizo una comunicación acerca de sus investigaciones. Él también disolvía el carbono en metal líquido, pero utilizaba la plata. La plata, así como el hierro, aumenta su volumen al enfriarse. “La ulterior disolución del lingote obtenido,-decía Jruschev, demostró que parte del carbono separado tiene las propiedades del diamante. Su polvo está compuesto de fragmentos y placas cristalinas incoloras transparentes, que refractan fuertemente la luz, absolutamente isotrópicas, que rayan el corindón y que se queman formando ácido carbónico con un residuo insignificante de ceniza”.
¡Cuántas eran las ideas que se presentaban para obtener el diamante artificial! L. Frank propuso buscar diamantes en el acero (antes de su laminado) en las fábricas metalúrgicas. El inglés Charles Parsons, el inventor de la turbina de vapor a reacción, descomponía el acetileno, dos átomos de hidrógeno y dos átomos de carbono, colocado en el cañón de una escopeta, disparando hacia él una bala por la parte de la boca. El francés Lyons propuso someter el bisulfato de carbono a electrólisis: el azufre se separa en el electrodo de estaño, y el carbono, en forma de diamante, claro está, en el electrodo de oro. El científico inglés W. Crookes, que descubrió una serie de fenómenos en los tubos de descarga de gases, pretendió obtener diamante en una bomba de acero rellena de explosivo.
Aquí se han enumerado sólo las tentativas más o menos serias de sintetizar diamantes.
En el año 1917 el físico-químico alemán Ruff hizo una comprobación minuciosa de todos los métodos publicados de sintetización del diamante y sacó la siguiente conclusión: “A excepción de Moissan, nadie logró obtener el diamante sintético. Es posible que Moissan lo obtuviera, pero eso no se ha demostrado...”
Los cristales considerados como diamante, eran carburos de composición compleja, que tenían una alta dureza. Se mantienen aparte los diamantes de Hannay, 12 granos obtenidos por él, se guardan en el Museo Británico. En el año 1943 Banister y Lonsdale realizaron su examen radiográfico y descubrieron que 11 cristales son realmente diamantes. No está todo claro acerca del origen de estos diamantes. El propio Hannay decía que en algunos de sus tubos él añadió cristales de diamante en calidad de cristal iniciador, pero los cristales artificiales se crearon allí donde no había cristal iniciador.
Una investigación más minuciosa de los diamantes de Hannay mediante el estudio del espectro de su luminiscencia al alumbrarlos con luz ultravioleta demostró que ellos son diamantes naturales. Posiblemente, los diamantes fueron colocados de antemano por los asistentes de Hannay con el fin de consolarle en las insistentes tentativas de lograr su objetivo.
Las dudas en la autenticidad de los resultados de Hannay surgieron ya antes y se fundaban en los intentos fallados de repetir sus experimentos y en la incoincidencia de las condiciones de sus experimentos con la zona de estabilidad del diamante, establecida más tarde. No obstante, los experimentos realizados con la participación de los autores de este libro demostraron que la formación del diamante puede suceder también en la zona de su metaestabilidad.
La probabilidad del engendramiento de un cristal de diamante es mucho menor que la de aparición del núcleo cristalino de grafito, pero no obstante existe. Si de una u otra manera se puede evitar la formación de grafito, pueden crearse y crecer cristales de diamante. Al mismo tiempo, últimamente los colaboradores del Instituto de Física de Altas Presiones de la Academia de Ciencias de la URSS mostraron que para distintos materiales de carbono la transformación a diamante transcurre a distintas temperaturas y presiones. Así, si los cálculos de O. I. Leipunski dan para la transformación del grafito en diamante el valor de 50.000 atm a la temperatura de 1.000 K, para la transformación del carbono vitrificado a diamante a la misma temperatura se requieren solamente 15 000 atm.
Pero nos hemos adelantado algo. Conforme a las palabras de O. I. Leipunski,
“con el trabajo de Ruff ha finalizado el período empírico de la síntesis del diamante. Se ha aclarado que el diamante no se puede hacer a la ventura. Es necesario determinar exactamente la temperatura y la presión, por encima de las cuales el diamante es más estable que el grafito, y realizar la cristalización precisamente en estas condiciones. La determinación de las condiciones de obtención del diamante era el contenido del período teórico de la historia del problema de creación de diamantes artificiales”.
§. Periodo teórico
El primer científico quien pretendió determinar teóricamente la zona de estabilidad del diamante y el grafito y hallar los límites entre estas zonas, fue el físico alemán Simón. Él trazó la dependencia entre la presión y la temperatura, para las cuales se obtiene el equilibrio del diamante y el grafito. Los resultados de Simón demostraron, más bien, el carácter de esta dependencia, pero no pudieron ser exactos, por cuanto en el año 1926, cuando él realizaba sus cálculos, muchas magnitudes fueron medidas con insuficiente fiabilidad.
El investigador soviético O. I. Leipunski ya tenía a su disposición unos valores muy precisos de las capacidades caloríficas del diamante y el grafito, así como de sus calores de combustión, obtenidos en 1937 por los norteamericanos Jessop y Rossini. Apoyándose en sus datos, Leipunski determinó la curva de equilibrio grafito-diamante. Este trabajo, finalizado por Leipunski en el año 1939, se considera clásico. Sus resultados numéricos prácticamente no variaron hasta la actualidad, pese a la gran cantidad de precisiones y correcciones.
Leipunski llegó a una importante conclusión: es más ventajoso cristalizar el diamante de la solución en metales fundidos, que mediante la transformación directa del grafito a diamante. La causa principal de esto es la mayor movilidad de los átomos de carbono en la solución, que en la red cristalina del grafito.
El científico mencionó también otras posibilidades de la síntesis del diamante: la intensificación de los cristales iniciadores de diamante en la fase gaseosa, la obtención de grandes diamantes policristalinos mediante la sinterización de diminutos polvos de diamante, y también formuló las condiciones indispensables de obtención del diamante artificial, la combinación del medio, la presión y la temperatura. Esto abrió una nueva era en la síntesis del diamante.
La previsión científica del eminente sabio soviético es sorprendente. Todos los métodos propuestos por él se realizaron no sólo en las condiciones de laboratorio, sino que también en la industria.
El ataque a mano armada de la Alemania fascista a la URSS interrumpió los trabajos experimentales en la obtención del diamante artificial. Surgió la necesidad de resolver otras tareas de mayor importancia para el país en aquella hora fatal. Después de la guerra Leipunski ya no se ocupó más de los diamantes. En el año 1942 otro científico soviético, D. A. Frank-Kamenetski, logró casualmente dedicar un poco de tiempo y fuerzas al problema de la creación del diamante, que le interesaba desde hace mucho tiempo. Él resolvía los problemas teóricos de la síntesis del diamante de la fase gaseosa. Por desgracia, el trabajo cumplido en los tiempos pesados de guerra no fue publicado.
Desde entonces ha pasado mucho tiempo. La ciencia ha ido muy adelante, y ahora el diagrama de fase del carbono, en el cual trabajó en cierto tiempo Leipunski, se ha extendido hasta un millón de atmósferas y hasta 5.000 K. En el diagrama de fase del carbono, calculado por Bandy, se halló incluso lugar para una modificación más, el carbono-3 (el carbono metálico). Bajo la acción de la presión de cerca de 600 mil at el diamante debe transformarse en carbono metálico. Los trabajos experimentales del académico L. F. Vereschagin y otros investigadores confirmaron la posibilidad de esta transformación.
§. Periodo experimental
En el año 1953 un grupo de científicos suecos logró por fin sintetizar el diamante. No obstante, ellos no comunicaron nada sobre su logro, esperando obtener cristales más grandes. Esta demora les prestó un mal servicio a los descubridores. En el año 1955 los científicos norteamericanos Bandy, Hall, Strong y Wentorf publicaron un artículo acerca de la síntesis del diamante en su laboratorio y fueron reconocidos en esta “carrera de diamantes” de muchos siglos, pese a que en realidad ellos fueron los segundos.
Al final de los años 50 el diamante fue sintetizado también por los científicos soviéticos, por (os colaboradores del Instituto de Física de Altas Presiones. Los trabajos fueron dirigidos por el académico L. F. Vereschagin. En la Sesión Plenaria del mes de julio (1960) del CC del PCUS el presidente de la Academia de Ciencias de la URSS M.V. Keldysh comunicó sobre el magnífico logro de los químicos soviéticos.
Pero crear el diamante en el laboratorio es realizar la mitad del asunto. Lo principal es organizar su producción en la industria. Pero esto está enlazado, en primer lugar, con la solución de los difíciles problemas de elaboración de la tecnología industrial de la síntesis del diamante. Un grupo de científicos del Instituto de materiales extraduros de Ucrania (hoy día pertenece al sistema de la Academia de Ciencias de la URSS) bajo la dirección de V. N. Bakul venció exitosamente estas dificultades. En la fábrica experimental del Instituto se produjo una partida industrial de diamantes y de artículos del mismo.
En nuestros días en muchos países (Checoslovaquia, Inglaterra, el Japón, Francia, Irlanda y otros) se ha organizado la producción de diamantes artificiales. Los métodos de síntesis del diamante se perfeccionan continuamente: la técnica y la industria exigen constantemente nuevas especies de materiales extraduros de calidad elevada.
La producción en gran escala del cristal artificial ha demostrado la justeza de la teoría, creada por los científicos, de su síntesis. ¿Cuál es la esencia de esta teoría?
Capítulo 5
Noción general de la nucleación
§. Etapa inicial de la formación del cristal
Antes de hablar sobre el crecimiento del cristal ya existente, se debe examinar la propia etapa inicial de su formación.
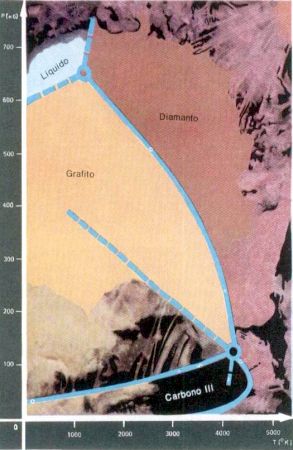
Diagrama de fase del carbono. Bajo la presión de 600 mil atmósferas, el diamante debe transformarse en carbono metálico.
Se tiene una solución de sal en agua. El agua a una temperatura determinada puede disolver una cantidad estrictamente determinada de sal, esta es la solubilidad de equilibrio.Luego disolvamos la sal a alta temperatura y enfriemos esta solución hasta una temperatura más baja. Entonces la solución será sobresaturada, y de ella comenzarán a precipitar cristales de sal. La relación de la cantidad de sustancia disuelta en el líquido a la cantidad de sustancia durante la solubilidad de equilibrio se llama sobresaturación.La sobresaturación representa la fuerza motriz del proceso de cristalización.
Tomemos ahora en vez de agua metal fundido, y en lugar de sal, grafito, y realicemos la misma operación. A bajas presiones (por ejemplo, a la atmosférica) en la solución se forma grafito, y a altas presiones, diamante.
Realicemos un experimento semejante con el vapor de agua. En el caso de un enfriamiento no muy grande de los vapores de agua, en el aire se forman gotitas de agua, y en el caso de un enfriamiento fuerte, trozos de hielo. En todos estos ejemplos la fuerza motriz, que hace pasar al sistema de un estado a otro, es la sobresaturación.
Estos procesos son estudiados en la parte de la química física, dedicada a la formación de una nueva fase. Esta parte incluye, a su vez, la parte sobre la etapa inicial de la formación de una nueva fase, de formación de su germen. Esta parte de la química física lleva el nombre de teoría de la formación de gérmenes, teoría de nucleación.
Qué es la nucleación. La palabra latina “nucleus” tuvo suerte: ella fue empleada para crear importantes términos científicos. En la física son los nucleones, las partículas que forman el núcleo del átomo. En la biología son los ácidos nucleicos, los componentes principales del núcleo de la célula. En la química física es la nucleación, el proceso de formación del núcleo (germen) crítico de la gota (o del cristal).
Por qué precisamente crítico, se explicará un poco más tarde, ahora miremos qué es lo que hace falta para que de los vapores de una sustancia cualquiera se forme una gota. Para esto es necesario que dos moléculas de vapor choquen entre sí y formen una pareja, que luego a ellas se asocie la tercera molécula, luego la cuarta, etc.
Sin embargo, semejante nudo de moléculas crece en general no tan tranquila y regularmente, como crece, digamos, una bola de nieve de los copos de nieve que se pegan uno a otro. Unas moléculas pueden adherirse y otras al mismo tiempo desprenderse. Todo depende de cuál proceso transcurre más rápidamente, la adhesión o el desprendimiento de moléculas.
Estos procesos son universales: suceden en la atmósfera, en los líquidos, en los aparatos industriales, durante la combustión, e incluso durante el vuelo de un avión que deja tras de sí una cola de niebla.
Capítulo 6
Para los que desean conocer más detalladamente
§. Formación de una nueva fase
En la química física se llama fase el volumen, homogéneo por su composición, de cualquier gas, líquido o sólido. Habitualmente nosotros operamos con la vecindad de dos, tres y más fases, como límites entre las cuales sirven las superficies interfaciales. Así, un vaso de agua incluye tres fases: el agua, el aire y el vidrio, y tres superficies interfaciales: agua-aire, agua- vidrio y vidrio-aire.
Al descender la temperatura del aire, los vapores de agua resultan sobresaturados y, condensándose, forman gotas. Dentro del líquido, sobrecalentado por encima del punto de ebullición, aparecen burbujas de vapor. Al enfriarse el agua, se cristaliza el hielo. Durante la evaporación y la concentración de la solución acuosa de sal precipitan sus cristales... Todo lo expuesto son ejemplos de la formación de una nueva fase, y uno de los casos particulares de semejante proceso es la obtención de cristales de diamante.
En condiciones de presión atmosférica normal el agua hierve y se congela a determinadas temperaturas. Los valores precisos de las temperaturas de estas dos transiciones de fase del agua han sido utilizados en calidad de base para la construcción de la escala de temperaturas de Celsio (escala centígrada). Uno de los puntos de base es la temperatura de formación del hielo, 0º, el otro, la temperatura de ebullición del agua, 100º. No obstante, si el agua se depura minuciosamente de los granos de polvo y se introduce en forma de una gota en suspensión en otro líquido de próximo peso específico, con el cual no se mezcla, entonces el agua se congela a una temperatura considerablemente más baja. El sobreenfriamiento récord del agua alcanza – 40º. Al mismo tiempo, el agua echada en una ampolla de vidrio muy limpia recién soplada, hierve a una temperatura superior a los 100º en unas cuantas decenas de grados.
Una paradoja interesante: cuanto más minuciosamente se realizan semejantes experimentos y se depura la sustancia de las impurezas, tanto mayor es el error que se obtiene al trazar la escala termométrica. La causa de la paradoja se reveló después de estudiar atentamente las etapas iniciales del engendramiento de una nueva fase.
§. Nucleación durante la condensación de los vapores
El vapor que se encuentra en equilibrio termodinámico con el líquido se considera saturado. En el sistema de vapor saturado y líquido la superficie interfacial en la unidad de tiempo interseca en ambos lados un mismo número de moléculas: cuantas moléculas se desprenden del líquido y pasan al vapor, tantas regresan al líquido del vapor. La gota de líquido en el vapor se encuentra en equilibrio si la presión del vapor que la rodea supera la presión del vapor saturado. Con otras palabras, el vapor se hace sobresaturado. La magnitud de la superación de la presión depende de la densidad del vapor, del radio de la gota, de su tensión superficial y densidad. La fórmula de esta dependencia fue obtenida por primera vez por el físico inglés William Kelvin.
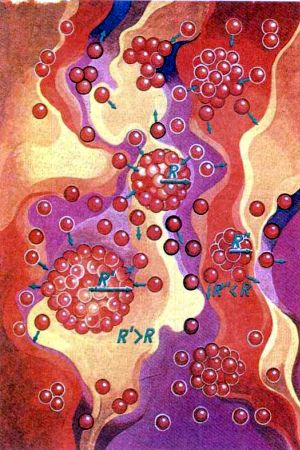
La fórmula muestra que cuanto menor es el radio de la gota, tanto mayor debe ser la superación de la presión del vapor para su equilibrio. O al contrario: cuanto menos saturado está el vapor, tanto mayor debe ser el radio de la gota que se encuentra con él en equilibrio. Para un valor determinado de la presión del vapor saturado, las gotas, el radio de las cuales es menor que el requerido, tienden a evaporarse y, por lo tanto, sus dimensiones disminuyen aún más. Las gotas de mayor tamaño, al contrario, tienden a seguir creciendo. Pues, la gota, cuyo tamaño corresponde a la presión del vapor sobresaturado que la rodea, se encuentra en un equilibrio no estable con él y tiene iguales posibilidades de seguir creciendo y de comenzar a evaporarse. Esta gota se llama núcleo critico de cristalización, y el proceso de su formación, nucleación.
Las probabilidades, que tienen en cuenta el carácter casual de los procesos de asociación de nuevas moléculas de vapor al agregado molecular y el lanzamiento del mismo, son tanto menores, cuanto mayor es el incremento de energía gastada para obtener el núcleo critico de cristalización. Este incremento es igual a la diferencia de la energía superficial de la gota y la energía que se libera a cuenta de la transición del vapor a líquido.
Al principio, al aumentar la dimensión de la gota aumenta el gasto de energía, porque prevalece la influencia de la energía superficial, que es proporcional al cuadrado del radio de la gota. Para el valor del radio igual al del núcleo critico cristalino, los gastos de energía alcanzan el máximo. Luego disminuyen, ya que prevalece la energía de transformación del vapor a líquido, que es proporcional al volumen de la gota, o sea, al cubo de) radio. En el proceso de nucleación el núcleo critico de cristalización se' encuentra en un equilibrio tan inestable como una esfera sobre otra esfera.
El físico teórico norteamericano J. Gibbs demostró que el incremento necesario de energía (trabajo de formación del núcleo crítico cristalino) es igual a un tercio de la energía superficial de la gota, es decir, es proporcional al cuadrado del radio de la gota. Pero, como ya fue indicado, cuanto menos sobresaturado está el vapor, tanto" mayor debe ser el radio del núcleo crítico de cristalización y, por lo tanto, mayor el trabajo de su formación.
Supongamos que, a pesar de todo, del vapor se ha formado una gota, que alcanzó y superó el tamaño del núcleo crítico de cristalización. Pero para esto en ella se tuvo que concentrar energía excesiva. Esto es posible únicamente a cuenta de las oscilaciones aleatorias, fluctuaciones que tienen lugar como resultado del movimiento térmico caótico de las moléculas. Cuanto mayor es el incremento necesario de energía, tanto con menos frecuencia sucederá su acumulación en la gota a cuenta de las fluctuaciones. Por esta razón, el número de núcleos críticos de cristalización que se forman en término medio en la unidad de tiempo, la velocidad de nucleación, descenderá al disminuir la sobresaturación. Los cálculos precisos han demostrado que la velocidad de nucleación depende muy bruscamente de la sobresaturación del vapor, que para un valor determinado de la tensión superficial define el radio y la superficie del núcleo de cristalización y, por consiguiente, el trabajo de su formación.
§. Nucleación durante la ebullición del liquido y lo cristalización
Se dedujo una dependencia análoga, pero más complicada, también para el caso de formación de burbujas en el líquido, llenas de su vapor, es decir, para el proceso de ebullición. La velocidad de nucleación durante la ebullición del líquido, a semejanza de su velocidad durante la condensación del vapor, depende en sumo grado de la tensión superficial del líquido y del área de la superficie de la burbuja. La diferencia consiste en que la tensión superficial está enlazada con la presión del vapor en la burbuja y con la presión en el líquido por la relación, que se desprende de la ley de Laplace. Ella expresa la diferencia de presiones en la burbuja y en el líquido por medio del radio de curvatura de la superficie esférica de la burbuja y la tensión superficial del líquido.
En el caso de la formación del cristal, por ejemplo, de una solución, la velocidad de nucleación depende de la energía superficial media de las caras del crista] en el limite con la solución. En este caso el área de superficie del núcleo crítico cristalino es inversamente proporcional al cuadrado del grado de sobresaturación de la solución. Para la síntesis del diamante a altas presiones se sobresatura el metal fundido con átomos de carbono, disolviendo en ella el grafito. A presiones lo suficiente altas (del orden de 60 kilobares) el grafito se hace menos estable que el diamante, y su solubilidad en los metales (es decir, la concentración de saturación) supera la solubilidad del diamante. Por eso simultáneamente el grafito puede disolverse y el diamante crecer.
§. Nucleación sobre soporte solido
A primera vista a todo lo dicho le contradicen las más simples observaciones- la condensación de los vapores de agua con la formación de niebla en el caso de sobresaturación muy pequeña o la ebullición del agua a una temperatura que supera muy poco los 100º. No obstante, estos hechos se explican porque en el primer caso las gotas de niebla se engendran en las partículas de polvo o sales, que siempre están presentes en la atmósfera; en el segundo caso las burbujas se forman, bien en las partículas en suspensión, bien en las paredes del vaso en el cual se hierve el agua. Aquí la teoría de nucleación, de formación de núcleos viables de la nueva fase, debe ser modificada: la presencia de soporte reduce la energía necesaria para la formación del núcleo crítico. Precisamente de esto se valen al provocar la lluvia artificial dispersando las partículas de sal sobre las nubes.
Ahora se hace claro por qué en las sustancias depuradas es difícil la aparición de una nueva fase y están desplazadas las temperaturas de las transiciones de fase. Por fin, se explica también la paradoja de los errores durante la realización minuciosa del experimento de trazado de la escala termométrica.
Examinemos la formación del germen de líquido sobre el soporte que éste moja.
Formación de la gota germinal ¡al microscopio! de los vapores de una sustancia cualquiera
Durante la formación de la lenteja germinal aparecen nuevas superficies interfaciales: en la superficie límite líquido-vapor (con el área S12 y la energía superficial σ12 y en la superficie límite líquido-apoyo (con el área S13 y la energía superficial σ13). En su formación se consumirá una energía, igual a
S12∙σ12 + S13∙σ13 (1)
Simultáneamente desaparecerá la superficie interfacial vapor-soporte en la misma área S13, pero con la energía superficial σ23. A cuenta de esto se liberará la energía S13∙σ23. En resumidas cuentas la energía (trabajo) necesaria para la formación del germen de liquido sobre el soporte será igual a
∆u = S12∙σ12 + S13∙(σ13 – σ23) (2)
Sea el ángulo interfacial, formado por la gota sobre el soporte, igual a Θ (véase la figura), entonces de la condición de equilibrio de las fuerzas de tensión superficial (representadas con flechas) se desprende:
σ13∙cos Θ = σ23 - σ13 (3)

Gota de un líquido sobre el soporte sólido.
Y en lugar de la ecuación (2) obtendremos.
∆u = σ12 (S12∙- S13 cos Θ) (4)
Si el ángulo Θ es pequeño y, por consiguiente, cos Θ es próximo a 1 y S13 no es mucho menor que S12, entonces la energía ∆u se hace sumamente pequeña. De aquí está clara la gran facilitación de la condensación a cuenta de la disminución del trabajo de formación del germen de líquido en el apoyo mojado en comparación con la condensación en el volumen de aire puro. La facilitación es tanto más considerable, cuanto más disminuye la energía superficial al sustituir el contacto del vapor con el soporte por el contacto de la gota con el apoyo.
Todo esto es justo también para la formación, sobre el soporte, del núcleo (germen) de fase sólida del cristal. La diferencia consiste únicamente en que en vez de la cúpula esférica el cristal está delimitado por caras planas. No obstante, con frecuencia, especialmente en un proceso rápido, en la etapa inicial de crecimiento, y tanto más en la etapa de formación del núcleo crítico cristalino no le da tiempo a formarse la "talla", y la forma del cristal engendrado puede ser próxima a la forma de la gota.
Independientemente de la forma exacta del núcleo se conserva la deducción principal sobre la facilitación de la formación del núcleo crítico cristalino en el caso cuando la energía superficial del apoyo disminuye bruscamente al formarse en él el núcleo. Algunos metales poseen una energía superficial especialmente grande. Precisamente en ellos, al descomponer los gases que contienen carbono, se descubrió la formación de cristales de diamante en las condiciones cuando, al parecer, deben ser más estables los cristales de grafito.
§. Mecanismo del crecimiento de los cristales y epitaxia
El mayor descenso del valor de la energía de formación del cristal y la energía superficial (hasta cero) se obtiene cuando el núcleo cristalino se forma en la cara de un cristal del mismo género. Es más, en este caso no surge el núcleo de la nueva fase, sino que sucede el crecimiento del cristal ya existente. Sobre este proceso se relatará cuando se hable acerca del crecimiento de los diamantes del gas. Ahora es importante comprender que el aumento puede suceder también a bajas presiones, cuando el diamante es una forma termodinámicamente inestable del carbono.
Para aclarar la posibilidad de este proceso, a primera vista, paradójico razonaremos de la manera siguiente. Sobre la superficie del cristal de diamante se desprenden los átomos de carbono. Pero, bajo la influencia de la acción de los átomos del soporte, dispuestos en un orden determinado, los átomos nuevos se forman de tal manera, como si continuaran la “mampostería de ladrillo" ya existente. La capacidad de las caras del cristal de facilitar el surgimiento de cristales de estructura semejante sobre su superficie se llama epitaxia. Cuando se trata del crecimiento de los cristales de la misma sustancia (por ejemplo, de diamante) entonces se habla de la autoepitaxia. Puede ocurrir también que la velocidad de afluencia de nuevos “ladrillos” al área edificable es demasiado grande y estando de prisa ellos comienzan a colocarse en desorden, formando carbono amorfo, o se establece un orden más simple que en el diamante, que corresponde a la estructura de los cristales de grafito.

Epitaxia. Los nuevos átomos se forman de tal manera como si continuaran la mampostería de ladrillo ya existente.
Las observaciones continuas de los gérmenes cristalinos en la cara del soporte de semejante estructura cristalina, revelaron su movilidad. Los gérmenes, en la etapa inicial de su formación, realizan movimiento browniano, bailando sobre la cara cristalina , inicial paralelamente a la superficie del soporte. Únicamente después, al envejecer y hacerse más pesados, ellos pasan a una existencia más sedentaria y, por lo visto, se adhieren más o menos sólidamente al soporte.
La semejanza o incluso la identidad de las estructuras del soporte y del cristal que se forma, en toda una serie de casos, no siempre conduce a la continuación ininterrumpida de la mampostería de ladrillo. Por lo tanto, al fenómeno de epitaxia no se le debe atribuir siempre el papel del motivo inmediato de la facilitación de la cristalización en la cara del cristal de semejante estructura. Pero, entonces, esta facilitación se puede explicar por el hecho de que la semejanza o identidad de las estructuras conduce a un valor bastante pequeño de la energía superficial en la superficie interfacial soporte-germen de la nueva fase.
§. Sobreenfriamiento del líquido y estado vítreo
El fenómeno de autoepitaxia se muestra con gran evidencia con ayuda de un experimento simple, pero muy interesante, que puede ser realizado por cada cual. En una masa fundida de azufre sumérjase, pendiente de un hilo, un cristal de azufre monoclínico y, pendiente de otro hilo, un cristal de azufre rómbico. Muy pronto Ustedes se convencerán de que, pese a las iguales condiciones, ambos cristales de distinta forma cristalina crecerán simultáneamente, aunque, posiblemente, a distinta velocidad. Si en la masa fundida de azufre no hay cristal iniciador, ella puede enfriarse por debajo del punto de cristalización normal. Llámase punto de cristalización normal la temperatura a la cual el azufre líquido y el cristalino se encuentran en equilibrio.
Es aún más fácil revelar la posibilidad de sobreenfriamiento del líquido, si se toma hiposulfito, utilizado en la fotografía en calidad de fijador, y, fundiéndolo a una temperatura de 70º aproximadamente, se enfría hasta la temperatura ambiente. En este estado él puede conservarse largo tiempo.
Corrientemente la cristalización de los líquidos sobreenfriados se ve obstaculizada por su alta viscosidad, Esta es característica para los líquidos enfriados con moléculas bien de composición compleja (vidrios de silicato), bien de agregados complejos que se forman con facilidad (moléculas de cuarzo). El físico-químico alemán G. Tamman demostró que, al superar la viscosidad el límite, del orden de 1014 poises, la cristalización frecuentemente resulta prácticamente imposible: la variación de la configuración de las moléculas está obstaculizada debido a su pequeña movilidad. (Poise es la unidad de viscosidad dinámica igual a la viscosidad del líquido que ejerce una resistencia con la fuerza de 1 dina al desplazamiento mutuo de dos capas de líquido de 1 cm2 de área, que se encuentran a la distancia de 1 cm una de la otra y que se desplazan mutuamente con una velocidad relativa de 1 cm/s.)
En esto se basa la propiedad del vidrio de conservar durante largo tiempo, a veces siglos enteros, su transparencia. Pero, de vez en cuando, ella se perturba: en el vidrio se forman cristales pequeños, el llamado velado del vidrio. En algunos casos se logra obtener en estado “vítreo” también sustancias con moléculas muy simples. Así, se conoce el carbono vítreo, que surge en determinadas condiciones.
Son interesantes las aventuras de la glicerina. Durante largo tiempo nadie podía obtenerla en forma de cristales. Pero, en Francia, un comerciante descubrió que había comprado a otro comerciante al por mayor glicerina en forma de cristales. El decidió que eso o no era glicerina, o era una muestra de ésta bastante sucia. En lo sucesivo, después del calentamiento y la fusión de los cristales de glicerina y la comparación exacta con la glicerina “normal” se aclaró su identidad. Así fue “descubierto” el raro fenómeno de cristalización de la glicerina. La causa de la cristalización resultó el traqueteo que experimentó la glicerina durante su transporte por el mar tormentoso.
Así, hemos examinado, claro está que en una forma muy simplificada, la teoría de la formación de una nueva fase y el aumento del cristal ya existente. Pero, ¿cómo se realizan estos procesos en la práctica, en los laboratorios?
Capítulo 7
Síntesis del diamante a altas presiones
§. Aparatos para la síntesis del diamante
Acordemos en que llamaremos altas presiones las que corresponden a la zona de estabilidad del diamante, y superaltas, las que superan 500 kilobar, por encima de las cuales se propaga nuevamente la zona de su metaestabilidad. Aquí la forma estable se hace el carbono metálico (el carbono-3). Se tienen en cuenta las presiones estáticas, es decir, a las cuales la muestra se encuentra bajo la influencia constante de la presión y la temperatura durante un tiempo bastante prolongado, por lo menos durante más de varios segundos. La síntesis del diamante a altas presiones estáticas se ha hecho el método técnico principal de obtención de diamantes sintéticos. Las presiones dinámicas se manifiestan al comprimir la sustancia con ayuda de las ondas de choque, provocadas, por ejemplo, con explosivo, en este caso tanto la presión como la temperatura se aplican a la muestra un tiempo muy corto-milisegundos. Los métodos dinámicos de síntesis y de investigación del comportamiento de las sustancias a altas presiones se aplican cada vez más ampliamente en la práctica, pero por ahora no pueden competir con los estáticos, pero los completan.
Es interesante, que estas dos orientaciones de los métodos de síntesis del diamante: a presiones estática y dinámica, han sido trazados por la propia naturaleza. En efecto, en las chimeneas diamantíferas en algunos tiempos actuaba la presión estática, y en los meteoritos, la dinámica.
Para crear altas presiones es necesario disminuir el volumen de la muestra a investigar, a temperatura constante o bien calentarla a volumen constante. Es aún mejor sí se logra disminuir el volumen de la sustancia al elevar su temperatura. Todo esto puede ser asegurado con ayuda de aparatos especiales.
Las presiones estáticas son creadas por potentes prensas, los esfuerzos de las cuales se transmiten a la cámara de alta presión. La prensa hidráulica desarrolla un esfuerzo de hasta decenas de miles de toneladas sobre una superficie determinada. La cámara de trabajo concentra este esfuerzo en un área de varios centímetros cuadrados. El aparato que une la prensa, creadora del esfuerzo, y la cámara, que concentra el esfuerzo en el volumen de trabajo, se llama multiplicador. La relación de la presión específica, obtenida en el volumen de trabajo, a la creada por la prensa, se llama coeficiente de multiplicación. Naturalmente que cuanto mayor sea el coeficiente de multiplicación, tanto mayor será la presión en la zona de trabajo de la cámara de alta presión. Con la multiplicación de la presión tropezamos también en la vida cotidiana: la mano junto con la aguja representa un multiplicador. Si les es interesante, calculen cuál es la presión en la punta de la aguja de 0,1 mm de diámetro, si ustedes aplican un esfuerzo de 1 kg (y si desean pueden aplicar un esfuerzo mayor).
No se puede disminuir considerablemente el área del espacio de trabajo de la cámara. Esto se explica porque, en primer lugar, es muy difícil trabajar con una zona de trabajo de pequeño volumen y, en segundo lugar, incluso los mejores materiales no soportan grandes cargas. Si el esfuerzo aplicado supera el límite de resistencia del material, este se destruye, limitando de este modo el aumento de la presión.
Hizo una gran aportación al desarrollo de la técnica de altas presiones el profesor de la Universidad de Harvard (EE.UU.) P. W. Bridgman, laureado con el Premio Nobel de física. Él no consiguió sintetizar los diamantes, pero gracias a sus investigaciones ello fue logrado por muchos otros. Precisamente Bridgman construyó la primera variante de la cámara de alta presión, capaz de mantener una alta presión y temperatura durante un tiempo bastante largo. La cámara, que recibió el nombre de “yunque de Bridgman”, representaba dos núcleos simétricos de aleación dura con secciones-yunques de trabajo planas; los núcleos de aleación dura iban encajados en un collar de acero templado. En el año 1940 la cámara de Bridgman permitió alcanzar una presión de 100 kilobar, lo que resultó un gran logro. Sin embargo, como le corresponde a la primera construcción, ella no estaba exenta de defectos: en primer lugar, un volumen de reacción muy limitado; en segundo lugar, unas pérdidas térmicas demasiado grandes, las cuales dificultaban la obtención y la estabilización de altas temperaturas.
Más tarde se propusieron muchas construcciones diferentes de cámaras de alta presión: molde esférico, cámara tetraédrica con conos directrices y otras. En muchos países ha hallado gran aplicación la cámara tipo “belt” (cinturón), construida por Hall y Bandy. Los científicos e ingenieros de la Unión Soviética crearon una serie de construcciones originales. Butúzov con sus colaboradores elaboró una cámara de seis punzones. Se utiliza ampliamente la cámara construida conjuntamente por los especialistas del Instituto de Materiales Extraduros de la Academia de Ciencias de la URSS y del Instituto de la Física de Altas Presiones de la Academia de Ciencias de la URSS. Esta cámara se parece a yunques lentiformes, en los cuales se coloca el container de reacción, de forma muy parecida a la lenteja. Esta instalación permite obtener presiones de hasta 200 kilobar y temperaturas de hasta 3.000 K.
La zona de reacción se calienta, haciendo pasar a través de ella corriente eléctrica, con la particularidad de que como contactos sirven los propios yunques. En la actualidad durante la síntesis se comprime y se calienta no la propia muestra, sino el container de reacción. Este último desempeña una serie de funciones: en primer lugar, transmite la presión del yunque a la muestra; en segundo lugar, forma el anillo obturador entre los punzones. Durante la compresión el material del container escurre entre los punzones y forma el anillo obturador. En la cámara de trabajo se establece el equilibrio entre la fuerza de rozamiento, que impide la salida, y la fuerza que empuja el material del container.
El material del container debe transmitir perfectamente la presión hidrostática, tener bajas conductibilidades térmica y eléctrica, alta temperatura de fusión, pequeña compresibilidad, en lo posible no reaccionar químicamente con las muestras que se utilizan. Con mayor frecuencia el container se hace de pirofilita, piedra litográfíca (caliza con impureza de componente arcilloso altamente disperso), talco (silicato acuoso de magnesio).
La presión en el volumen de reacción se mide por el método de fijación de las transiciones de fase, que utiliza el hecho de que durante la transición de fase varían bruscamente muchas propiedades de las sustancias. El método fue fundamentado por las investigaciones de Bridgman, quien estableció la relación entre la resistencia eléctrica y la presión para muchos elementos y compuestos. En este método se utiliza ampliamente el bismuto, el cual, para distintas presiones aplicadas sobre él, forma una serie de modificaciones polimorfas. Así, el bismuto I se transforma en el bismuto II al aplicarle 25 kilobar, con la particularidad de que su resistencia disminuye en un 83%; el bismuto II, a su vez, se transforma en bismuto III a 27 kilobar, aumentando el doble la resistencia. Por fin, cuando el bismuto V se transforma en bismuto VII con la disminución de la resistencia, la presión en la cámara de reacción es igual a 89 kilobar.
La temperatura en la cámara de reacción se mide por distintos métodos. Ella puede ser apreciada aproximadamente conforme a la potencia consumida. Se utilizan también las observaciones de la fusión de algunos metales (introduciendo, naturalmente, la corrección debida a la influencia de la presión). Pero la más aplicada es la medición de la temperatura con ayuda de termopares, que se introducen directamente en la cámara de reacción.
Naturalmente que todos los métodos de medición de las presiones y las temperaturas tienen sus particularidades y sus detalles experimentales, los cuales deben ser tomados en consideración por el investigador.

Esquema del dispositivo para la síntesis de los diamantes a altas presiones. La presión estática se crea por prensas potentes, los esfuerzos de las cuales se transmiten a la cámara de alta presión. La prensa hidráulica desarrolla un esfuerzo de hasta decenas de miles de toneladas sobre una área determinada.
Materia prima inicial para la síntesis del diamante En el container se coloca una mezcla de grafito con metal; níquel, hierro, manganeso y otros. Se emplean también las aleaciones de metales, por ejemplo, del níquel con el manganeso. La síntesis del diamante comienza después de la fusión del metal. La influencia de los metales en el proceso fue investigada detalladamente, pero hasta hoy día no está todo claro en este proceso. Principalmente se utilizan los metales del grupo del hierro con distintas adiciones. En la inmensidad de patentes de los distintos países se han "metido” no sólo todos los elementos, sino que también todas las posibles aleaciones y compuestos intermetálicos. La mayoría de los investigadores, en la apreciación del papel de los metales en la síntesis, se han dividido en dos grupos.

"Yunque de Bridgman", la primera variante de cámara, capaz de mantener durante largo tiempo altas presiones y temperaturas. Dos núcleos simétricos de aleación dura están empotrados en una caja de acero duro.
El primer grupo examina el metal simplemente como disolvente del carbono, y el segundo, el hincapié principal lo hace en las propiedades catalíticas del metal. Por esta razón, no hay que sorprenderse si en la literatura se tropieza con distintas denominaciones de un mismo metal o aleación: metal disolvente o metal catalizador.
Nosotros hablamos sobre los átomos de carbono, disuelto en el metal, en realidad el metal puede formar distintos compuestos con el carbono, por ejemplo, carburos, incluyendo los metaestables. Posiblemente, estos carburos son precisamente los transportadores del carbono al diamante en crecimiento. En todo caso, el metal o la aleación, empleado en la síntesis del diamante, debe mojar bien el diamante y el grafito, disolver el carbono, y además poseer una temperatura de fusión suficientemente baja (de lo contrario la temperatura de la síntesis y, por lo tanto, también la presión aplicada serán muy altas).
El tipo de material carbonoideo y su grado de dispersión influyen esencialmente en la velocidad de la síntesis y en el rendimiento 'de diamante en una sinterización a presión (es decir, en un ensayo). El conocido investigador de los materiales de carbono y grafito V. L Kosátochkin demostró que en la transformación a diamante influye la capacidad de los materiales carbonoideos de grafitizarse, o sea, formar una estructura característica para el grafito. Si el material inicial se grafitiza, entonces la síntesis finaliza más rápidamente y el rendimiento de diamante es mayor que en el caso de material carbonoideo no grafitizable.
Ahora se conocen muchas variedades de materiales carbonoideos.

Cámara de seis punzones para crear altas presiones, construida por los científicos soviéticas.
Entre ellas los grafitos naturales, carbones, el coque, los materiales sintéticos; pirografito, carbono vidrioso y otros. Los grafitos artificiales se obtienen, bien haciéndolos precipitar de la fase gaseosa durante la pirólisis de los hidrocarburos, bien mediante la carbonización del alquitrán de carbón mineral a altas temperaturas. En dependencia del régimen de tratamiento: la temperatura, el tiempo, la presión,-los materiales obtenidos poseen una estructura próxima, en distinto grado, a la estructura del grafito. Ellos se distinguen por el grado de grafitización, es decir, por el grado de aproximación a la estructura del grafito.
Existe una gran cantidad de combinaciones de metales, aleaciones y distintos materiales carbonoideos.
He aquí, por ejemplo, la composición de la mezcla para la cultivación de diamantes, propuesta en el Japón por la firma K. K. Komatzu Seisakuse: “La mezcla representa un aglomerado de polvo fino de metal catalítico y de polvo carbonoideo de estructura distinta de la del diamante, por ejemplo, de grafito, en la cual el contenido de componente carbonoideo constituye menos del 6-40% de la magnitud necesaria para la saturación con carbono en las condiciones de cultivación de los cristales de diamante.
La zona de catalizador fundido se desplaza por la pieza bruta carbonosa, con la particularidad de que la posición se prefija con ayuda del gradiente local de temperatura, aplicado sobre la pieza bruta y que se mueve por su largo. La zona de fusión se obtiene en un aparato elemental de presión con auxilio de un elemento calentador en espiral, que tiene un conjunto de uniones de sección. La corriente de cada sección se regula de tal modo que se forme el perfil requerido de temperatura con la cresta local de temperatura para crear la zona de fusión y para asegurar el desplazamiento de esta cresta a lo largo de la pieza bruta”.
§. Parámetros del proceso de síntesis
La temperatura y la presión de la síntesis ejercen una influencia decisiva en la forma de los cristales de diamante. A bajas temperaturas crecen principalmente cristales de forma cúbica; a altas, octaedros; a temperaturas intermedias, octaedros cúbicos. Como sabemos, la variación de la temperatura lleva tras de sí la variación de la presión. No se pueden conservar los parámetros del proceso, correspondientes a la zona de estabilidad del diamante, si se varía arbitrariamente la temperatura, sin crear la presión necesaria. Efectivamente, al elevar la temperatura se puede pasar de los límites de la zona de estabilidad del diamante, si no se aumenta simultáneamente la presión.
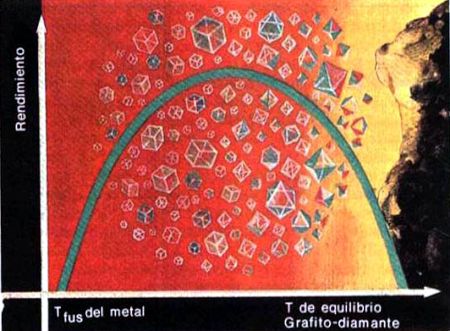
Curva de dependencia del crecimiento de los cristales de la temperatura A baja temperatura crecen principalmente cristales de forma cúbica, a alta, octaedros.
A presión constante el rendimiento de cristales de diamante depende de la temperatura, con la particularidad de que existe tal temperatura a la cual el número de cristales obtenidos después de la síntesis es el máximo. Este máximo es fácil de explicar. Efectivamente, sea que la presión en la zona de reacción se mantiene invariable y la temperatura se eleva desde cero hasta la correspondiente al punto de transición de fase grafito-diamante. Entonces, a temperaturas inferiores a la de fusión del metal la velocidad de nacimiento del diamante será muy pequeña, prácticamente igual a cero. La velocidad de formación de sus cristales también será igual a cero a la temperatura correspondiente a la curva de transición de fase grafito-diamante. La mayor velocidad de cristalización del diamante se observará a una temperatura intermedia-por encima de la temperatura de fusión del metal, pero inferior a la temperatura de equilibrio grafito-diamante. Con otras palabras, se observa el máximo de velocidad de formación de los cristales.
La confrontación del número de cristales de diamante hallado después de la síntesis con la velocidad de formación debe realizarse con mucho cuidado. Habitualmente esto se hace de la manera siguiente. Después de la sinterización a presión y la ulterior depuración química del diamante del metal y el grafito que no reaccionó, se calcula el número de cristales de diamante. No obstante, durante la separación del diamante después de la síntesis se pierde inevitablemente la fracción más menuda de diamantes: ella no se capta incluso con ayuda de las mejores centrífugas. Por esta razón, el cálculo del número de cristales después de la síntesis muestra sólo el cuadro cualitativo: para cuáles parámetros se alcanza la mayor velocidad de formación de los cristales de diamante, pero no ofrece la dependencia cuantitativa (numérica): cuántos diamantes precisamente pueden obtenerse con los parámetros dados.
§. Formación de los gérmenes (núcleos) y crecimiento del diamante
El crecimiento del diamante se puede dividir en dos etapas principales: la formación de gérmenes (la etapa de nucleación) y el crecimiento del cristal formado.
En la etapa de nucleación, como ustedes ya saben, se forman los gérmenes críticos de diamante, es decir, los cristales de tal tamaño, que son capaces de seguir creciendo. En la química física clásica se distinguen dos casos principales de formación de la nueva fase: la nucleación homogénea y la heterogénea. Durante la nucleación homogénea el germen cristalino crítico confina por todos los lados sólo con el medio de cristalización, y en el caso de nucleación heterogénea, el germen se forma en la superficie de cierto cuerpo ajeno.
Comparemos ahora estos dos casos de nucleación.
Si se toma una mezcla de polvos de grafito y de metal y se les lleva al estado correspondiente a la zona de estabilidad del diamante, en la cual el metal se encuentra en estado fundido, la velocidad de nucleación homogénea será ínfimamente pequeña. Principalmente esto está relacionado con el hecho de que la energía superficial en la superficie interfacial diamante-metal es bastante grande.
Las apreciaciones de la velocidad de nucleación heterogénea proporcionan unos valores más atrayentes, por consiguiente, el diamante comienza a cristalizarse sobre ciertas superficies ajenas. En efecto, en muchos de los diamantes sintéticos se observan inclusiones de grafito y carburos de metales. Los diamantes naturales también contienen frecuentemente inclusiones de minerales asociados.
Examinemos la hipótesis interesante sobre la formación de gérmenes de diamante, desarrollada por Ya. A. Kaláshnikov, colaborador del académico L.F. Vereschaguin. Esta hipótesis es como si dijéramos el híbrido de las ideas de disolvente y catalizador. El grafito puede disolverse en el metal por bloques, y resulta algo semejante a una disolución coloidal. Las partículas grandes de grafito, si se les da tiempo, se disuelven poco a poco. Si la temporización es bastante grande ellas desaparecen por completo, formando una disolución de carbono verdadera en el metal fundido. Pero el proceso de síntesis del diamante se mide en segundos y minutos; durante este tiempo las partículas de grafito de tamaño coloidal todavía se conservan.
A continuación Kaláshnikov hace la conjetura de que los átomos de metales pasan (difunden) a través de los planos reticulares (de espesor igual a un átomo) del grafito, destruyen los enlaces de tipo de grafito y los transforman en los de diamante. Con otras palabras, existe una aguja peculiar que une los planos reticulares del grafito en el cristal de diamante.
Sin embargo, este no es el único mecanismo de transformación posible. Los autores de este libro demostraron que las partículas de grafito de determinada forma pueden transformarse en diamante por sí solas, por cuanto su existencia en forma de diamante es más ventajosa desde el punto de vista termodinámico, es decir, el estado en forma de diamante tiene menor energía.

Formación y crecimiento de los cristales de diamante en metal fundido a presión estática
Por esta razón, el mecanismo de la etapa inicial de formación del diamante a altas presiones puede ser representado de la manera siguiente. A la solución de metal pasan las partículas de grafito de distinta forma.
Para algunas de ellas es posible la transformación a diamante, lo que precisamente sucede. Estos gérmenes de diamante continúan creciendo, y las partículas de grafito que no se han transformado en diamante se disuelven.
El carbono disuelto se consume en la alimentación adicional del diamante en crecimiento. Esta teoría explica el papel de los metales que se emplean en la síntesis del diamante, como disolventes y catalizadores peculiares (aceleradores del proceso químico). Efectivamente, para que se forme el germen de diamante, las partículas de grafito deben pasar a la solución. Esto lo hace el metal disolvente. Además, son más perspectivos para la síntesis aquellos metales, en la superficie interfacial con los cuales la energía superficial del diamante es la mínima. Esto facilita la formación del diamante, y esta acción del metal puede llamarse convencionalmente catalizadora.
Al mismo tiempo este enfoque permite indicar las propiedades necesarias de los materiales de grafito que se utilizan en la síntesis del diamante. Evidentemente, el material de grafito debe contener ya en sí mismo aquellas partículas que son capaces de transformarse luego en diamante, es decir, él debe tener una estructura determinada. Existen una serie de materiales de carbón y grafito, los cuales se disuelven fácilmente en metales fundidos, pero, como no tienen estructura cristalina, no son capaces de formar diamante durante la síntesis. A estos materiales pertenecen, en primer lugar, ciertas especies de carbono vidrioso y el negro de carbón.
Supongamos que por uno u otro procedimiento se ha formado el germen cristalino de diamante, capaz (sólo hace falta que hayan condiciones para ello) de seguir creciendo. El pequeño cristal crecerá en un medio sobresaturado con respecto al diamante, asociando átomos (posiblemente, bloques enteros) de carbono del grafito. Las investigaciones han demostrado que en el momento inicial la velocidad de crecimiento del diamante es muy alta y puede alcanzar 60 micrones por segundo. Luego la velocidad de crecimiento disminuye. Los cristales de diamante de distintas formas, a igualdad de condiciones, tienen distintas velocidades de crecimiento. La mayor velocidad lineal inicial de crecimiento se observa para los octaedros cúbicos.
§. Zonas cinética y de difusión del proceso
El proceso de crecimiento del cristal como si estuviera dividido en dos operaciones: el transporte del material de construcción y su incorporación en el cristal. Si la velocidad de transporte de los átomos de carbono a la superficie del diamante es grande, su crecimiento depende principalmente de la segunda operación, o sea, se determina por la velocidad de incorporación del carbono en la red del diamante. Este proceso transcurre en la zona cinética. Si el carbono se incorpora en la red rápidamente, mientras que su transporte a la superficie del cristal, que tiene lugar a cuenta de la difusión, está dificultado, entonces la velocidad de crecimiento del diamante se determina por la etapa más lenta (etapa limitadora), por la difusión. El proceso transcurre en la zona de difusión. En este caso alrededor del cristal en crecimiento se forma una zona empobrecida de carbono. Dicha zona se puede observar en las fotografías. La zona empobrecida lleva el nombre de “patio de cristalización”.
Todo el proceso de crecimiento del cristal de diamante se puede representar sumariamente en la forma siguiente. El grafito y el diamante se encuentran separados por una capa de metal. En la zona de estabilidad del diamante la concentración de carbono en el metal líquido en equilibrio con el grafito es mayor que en equilibrio con el diamante. Por eso en esta zona el grafito puede disolverse, y el diamante crecer. Los átomos de carbono del grafito difunden a través de la capa de metal y se asientan sobre el diamante.
Si durante la etapa de nucleación se han formado pocos cristales, y la velocidad de su crecimiento es pequeña y ellos no obstaculizan uno a otro el crecimiento, se obtienen cristales de diamante separados, bien facetados. Si se forman cristales que crecen a velocidad muy alta, entonces ellos, como regla, tienen una estructura defectuosa. La formación de cristales defectuosos está relacionada no sólo con la alta velocidad de su crecimiento, sino también con la gran desigualdad de la temperatura y presión en los distintos puntos del volumen de las cámaras reales. En efecto, es difícil esperar un diamante perfecto por su facetado y propiedades internas, si la temperatura a lo largo de él varía en varias centenas de grados. A veces se forma una cantidad tan grande de gérmenes cristalinos de diamante, que los cristales se adhieren uno a otro, formando placas continuas con vértices salientes de cristales separados, las llamadas escobillas. Cabe señalar que los cristales en las escobillas siempre están bien facetados, por cuanto la velocidad de su crecimiento es pequeña.
Durante el crecimiento del diamante rige la ley general: cuanto más alta es la temperatura, tanto más rápidamente finaliza la síntesis, tanto más menudo, defectuoso y peor es el facetado de los cristales de diamante. No obstante, a igualdad de las demás condiciones, el rendimiento de diamantes en una sinterización a presión aumenta.
La industria necesita diamantes muy diferentes, por eso los diamantes se sintetizan en condiciones muy distintas.
¿Y donde están tos diamantes de gran tamaño? Esta pregunta le surgirá obligatoriamente al lector. Hay que reconocerlo, prácticamente todos al oír la palabra “diamante” se imaginan precisamente un brillante, un cristal que no sólo debe ser grande, sino también de una calidad de artículo de joyería, transparente, sin inclusiones y defectos. La técnica de síntesis de diamantes dispone hoy día de la posibilidad de crear semejantes cristales. Un experimento similar fue realizado por Strong en la cámara tipo “belt”. En el container, sobre el cristal iniciador de diamante se colocaba la capa de metal. Como fuente de carbono servía también el diamante, mejor dicho, el polvo de diamante. La temperatura del polvo superaba la temperatura del cristal en 50º, y esta diferencia de temperaturas se mantenía con una exactitud de hasta un grado. El proceso continuaba varias centenas de horas, y como resultado se obtuvieron cristales bien facetados, de calidad de joyería, de hasta 0,6 quilates. No obstante, su precio superaba en tanto el precio de los diamantes naturales análogos, que era inútil hablar acerca de la aplicación práctica de este método. Quizás, precisamente por eso este método de síntesis de los cristales de diamante no fue patentado y sobre los experimentos de Strong sólo se comunicó en un artículo de revista.
En esencia, el problema de grandes cristales reside en el problema de las dimensiones de las cámaras de alta presión. Es que el cristal no puede hacerse mayor que el recipiente en el que él se cultiva. Al contrario, las dimensiones del espacio de cristalización deben superar considerablemente las dimensiones esperadas del cristal de diamante. Pero cuanto mayor es la cámara de cristalización, tanto más difícil es crear en ella las presiones y temperaturas requeridas, y mantener los parámetros del proceso invariables es aún más difícil. La propia síntesis del diamante impide esto. Efectivamente, el diamante tiene una densidad de 3,5 g/cm3, y el grafito utilizado para la síntesis en el mejor de los casos, de 1,8 a 2,0 g/cm3. Por lo tanto, en lugar de dos volúmenes de grafito se forma prácticamente un volumen de diamante. Además, varían las propiedades eléctricas de la zona de reacción debido a la transformación del grafito, conductor de la electricidad, en diamante no conductor.
Como se ve, las dificultades en el camino de la creación de la tecnología industrial de obtención de grandes monocristales de diamante son más que suficientes. Es necesario contar con la dificultad de este problema, y, posiblemente, no hay que apasionarse por él, pues en la actualidad se han creado grandes diamantes sintéticos policristalinos que sustituyen con éxito incluso a los diamantes naturales en muchas ramas.
§. El diamante y la explosión
Hemos relatado sobre la síntesis del diamante en presencia de metales a presión estática. Pero, como ya se dijo, actualmente se desarrollan también los métodos de obtención de diamantes a presiones dinámicas a causa de cargas de choque. La cámara de cristalización en este caso es un cilindro de paredes gruesas con émbolo desplazable, sobre el cual se encuentra la carga explosiva. Debajo del émbolo, en un vaso especial, se encuentra la capa de grafito. Después de la explosión de la carga por el grafito se propaga la onda de choque. Durante el tiempo de 3 a 6 milisegundos el grafito se somete a la presión de hasta 150 kilobar y a una temperatura de 2.500 ºC. Tiene lugar la transformación directa de parte del grafito en diamante. En este caso, junto con el diamante ordinario cúbico, se forma su modificación hexagonal, la lonsdeilita, que se ha descubierto también en los meteoritos.
Ahora ya conocemos cómo se obtiene el diamante a altas presiones, es decir, en la zona de su estabilidad. ¿Es posible acaso la síntesis del diamante en la zona de estabilidad del grafito?
Capítulo 8
Crecimiento del polvo de diamante a bajas presiones
§. Esencia del proceso
El crecimiento del diamante en la zona de presiones y temperaturas a las cuales él se hace una forma menos estable del carbono, y la forma estable es el grafito, es posible. En este caso se habla sobre la obtención del diamante a bajas presiones. Las presiones bajas son las presiones tanto de centenas de atmósferas, como de fracciones de atmósfera. El problema consiste en que mediante la elección de las correspondientes condiciones de experimento hacer más probable la aparición del germen cristalino y el crecimiento del diamante.
La probabilidad de crecimiento del diamante aumenta considerablemente si ya existe cristal iniciador del cristal de diamante. En un medio de hidrocarburo correspondiente, por ejemplo, en el metano, sobre la superficie del cristal iniciador de diamante suceden las reacciones de descomposición:
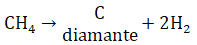
o bien
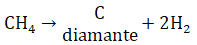
En el caso de concentración de equilibrio, los números de átomos de carbono, que se asocian al cristal y que dejan su superficie, son iguales, así que el cristal crece y se decapa al mismo tiempo y la velocidad total de su crecimiento es igual a cero. Si la concentración de átomos de carbono es mayor que la de equilibrio, el exceso de éstos (en comparación con la concentración de equilibrio) se desprenderá en la cara (faceta) del cristal. En este caso, bajo la influencia de la autoepitaxia, ellos tenderán a continuar la “mampostería de ladrillo” del soporte. No obstante, si la concentración de átomos de carbono cerca del cristal es demasiado grande y el proceso de su desprendimiento sobre la cara del cristal iniciador transcurre demasiado rápido, entonces se hace posible la formación y el crecimiento del grafito como la forma de carbono más estable desde el punto de vista termodinámico, lo que prevalece la influencia de la autoepitaxia. Al principio, la formación del grafito y el crecimiento del diamante transcurrirán simultáneamente en distintas secciones de la superficie, pero luego el grafito cubrirá toda la superficie del cristal y el crecimiento del diamante cesará, Los cálculos termodinámicos demuestran que la concentración de equilibrio de carbono en los compuestos químicos, en el vapor y en la disolución sobre el diamante a bajas presiones es mayor que sobre el grafito.
Por esta razón, siempre existe la probabilidad de aparición del grafito, que bloquea la superficie del diamante y que excluye su ulterior crecimiento.
La principal dificultad del crecimiento del diamante a bajas presiones reside precisamente en evitar la separación del grafito o eliminar la fase estable del carbono, el grafito. Esto se hace por distintos procedimientos.

Crecimiento del diamante en la fase gaseosa a presiones bajas. El metano se descompone, en la superficie del cristal se acrecienta el diamante (abajo) y el grafito (arriba)
Se puede interrumpir periódicamente la síntesis y alejar por uno u otro método el grafito de la superficie de los cristales de diamante. Se puede elegir tales condiciones de síntesis, cuando la velocidad de crecimiento del diamante es tanto mayor que la de crecimiento del grafito, que las inclusiones de este último serán “emparedadas” en las capas de diamante. Por fin, se puede hacer la tentativa de crear tal régimen de síntesis, que el grafito no se forme en general.
Es bastante seductor el deseo de aumentar el tamaño de los cristales de diamante en el correspondiente medio carbonoideo. El primer intento de semejante experimento se refiere a principios de nuestro siglo, y ahora con mayor frecuencia aparecen en distintos países patentes y artículos de revista sobre esta cuestión.
En el año 1956 los científicos del Instituto de Química Física de la Academia de Ciencias de la URSS B. V. Deriaguin y B. V. Spitzin lograron recibir la primera patente sobre el acrecimiento de los cristales iniciadores de diamante a partir del gas. En sus experimentos ellos utilizaban el tetrabromuro de carbono. Al cabo de cierto tiempo, en el año 1958, el norteamericano V. Eversole recibió dos patentes acerca del acrecimiento de los polvos de diamante. En la primera de ellas se examina el crecimiento del diamante de los hidrocarburos que contienen grupos metílicos, en la segunda, su crecimiento al descomponer el monóxido carbónico. Por cuanto simultáneamente con el diamante crece también el grafito, Eversole interrumpía periódicamente el proceso y alejaba el grafito mediante el decapado en medio de hidrógeno a 100 at y 1000 at.
§. Aparatos y metodología del acrecimiento de los polvos de diamante.
Un grupo de investigadores, encabezado por B. V. Deriaguin y D. V, Fedoséev, estudiaba experimental y teóricamente la síntesis del diamante a partir de los gases, pretendiendo penetrar en el mecanismo del crecimiento del diamante y el grafito. Desde el principio en su trabajo se entrelazaban estrechamente dos objetivos: el científico y el práctico.
Ante todo los experimentadores aclaraban la dependencia de la velocidad de crecimiento del diamante (y de paso del grafito) de tales parámetros, como la temperatura y la presión de los gases carboníferos. Los experimentos se realizaban en las instalaciones de laboratorio, que constaban de un reactor de síntesis y del sistema de vacío. El reactor generalmente es de forma cilíndrica, se hace de cuarzo y es capaz de soportar una temperatura de hasta 1.200 ºC. El se encuentra dentro de un horno, el cual se ha hecho de alambre o de cinta' de aleación especial. Al pasar la corriente eléctrica, la cinta se calienta y se calienta también a su vez el reactor. La temperatura del reactor se mide con ayuda de varios termopares, colocados en un recipiente especial de cuarzo.
El sistema de vacío incluye las bombas de vacío, el bloque de depuración y almacenamiento de los gases, una serie de manómetros de distintos tipos para medir la presión de los gases en un amplio intervalo de presiones y un indicador del gasto de gas.
El polvo de diamante se pesa preliminarmente y se coloca en el reactor en una taza pequeña de cuarzo. En las primeras instalaciones para el estudio de la cinética del crecimiento del diamante, la cantidad de polvo constituye cerca de 0,1 quilate, es decir, 20 mg. La taza con el polvo de diamante se suspendía, con ayuda de un hilo largo y fino de cuarzo, de un muelle graduado, hecho de una espiral de cuarzo. La propia espiral se encontraba en la zona fría del reactor, y la taza con el polvo de diamante, en la caliente. Con ayuda de un pequeño microscopio con divisiones se observaba una marca especial en la punta de la espiral: así, con la exactitud de milésimas partes de gramo, se medía la variación del peso de la muestra de diamante.
En todas las mediciones, relacionadas con la investigación de la cinética del crecimiento del diamante, se empleaban polvos de diamante altamente dispersos (finamente desmenuzados), los cuales poseen una gran superficie específica, que es la superficie total de todas las partículas contenidas en I g de polvo. Cuanto menor es el tamaño de las partículas, tanto mayor es la superficie específica. Ustedes mismos pueden cerciorarse fácilmente de esto triturando sucesivamente, por ejemplo, el cubo inicial con una arista de 1 cm en cubos de menor arista.
Supongamos que durante el proceso de crecimiento se ha obtenido una capa de diamante de 10 Angstrom. Si se toma un cristal de diamante de 20 mg de peso, entonces éste representará un cubo con una arista de cerca de 4 mm y una área total de cerca de 1 cm2. ¿A qué será igual el aumento de peso del diamante obtenido en este caso? Conociendo la densidad del diamante es fácil hallar que el aumento de peso será igual a 0,35∙10-3 μ y se encuentra fuera de los límites de la sensibilidad de la balanza elegida por nosotros.
Tomemos ahora los mismos 20 mg, pero en forma de polvo, con unas partículas tan diminutas, que su superficie específica será igual a 10 cm2 por 1 g de diamante.
En este caso la superficie total del polvo, en la cual puede suceder el crecimiento del diamante, constituirá 0,2 m2, y el aumento de peso, 0,7 mg, lo que es mucho mayor que la sensibilidad de la balanza.
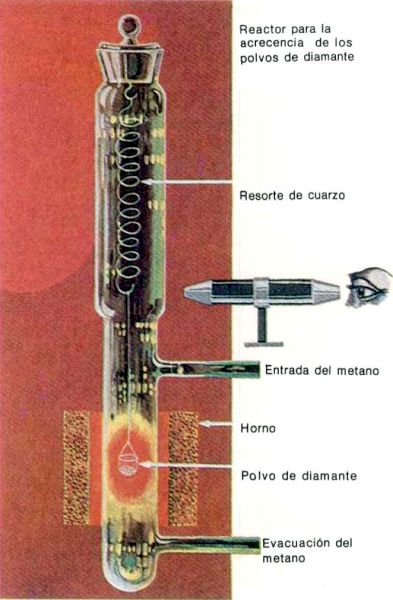
Reactor para la acrecencia de polvos de diamante. Consta del reactor y el sistema de vacio. El reactor es capaz de soportar una temperatura de hasta 1200 C
Así pues, para dado aumento de peso del diamante se puede medir la velocidad de su crecimiento.
§. Superficie especifica
Ésta es una de las características más importantes de los materiales pulverulentos, y no en vano para muchos de ellos ella se incluye en la Norma Estatal. La importancia de esta característica consiste en que de ella depende esencialmente la eficacia de muchos procesos tecnológicos.
En los hogares de las centrales termoeléctricas se quema carbón finamente triturado y mazut pulverizado. En este caso, en dependencia del tamaño de las partículas de carbón o de las gotas de mazut, es decir, de su superficie específica, se logra la velocidad prefijada de liberación de energía durante la combustión.
Los medicamentos también se secan en forma de polvos con una superficie específica prefijada. Muchos medicamentos se preparan de tal modo que después de ser tomados se desintegren en polvo con la superficie específica requerida. De este modo se puede regular la velocidad de admisión del medicamento en el interior del organismo.
Al introducir los abonos, particularmente con la ayuda de la aviación, se utilizan también los polvos con requerida superficie específica.

Determinación de la superficie especifica. En el polvo (al microscopio) se traza una línea recta imaginaria y se forma alrededor de esta un cilindro con pequeña área de sección. El cilindro como si cortara en el polvo una columna con cierto volumen total de las partículas de polvo. Valiéndose de fórmulas especiales se calcula este volumen.
Por fin. observen cómo se comporta, el azúcar rápidamente soluble, al meterlo en el té. El se desintegra en diminutos cristales separados, los cuales se disuelven independientemente. Precisamente este hecho lo hace rápidamente soluble.
Claro está que se han creado muchos métodos de determinación de la superficie específica de los materiales en polvo. Pero con toda la aparente variedad de estos métodos ellos se pueden dividir en tres grupos principales.

Puros interiores y de transporte en el polvo (al microscopio).
El primer grupo incluye los métodos de determinación de la superficie específica mediante la medición directa de las dimensiones de las partículas al microscopio. Luego se calcula la superficie específica. Hasta no hace mucho tiempo esta operación se realizaba prácticamente a mano. El laborante, inmediatamente en el microscopio o en la fotografía realizaba las mediciones. Actualmente se han creado instrumentos, en los cuales esto se realiza automáticamente. Esto se funda en el principio del haz electrónico explorador, semejante al que se utiliza en el televisor. El haz electrónico corre por la superficie de la placa, sobre la cual se han aplicado los granitos de polvo, y la máquina numérica cuenta su reflexión de las partículas.
El segundo grupo de métodos de medición de la superficie específica está relacionado con la absorción de los gases por la superficie del material. Éstos son los llamados métodos por adsorción. El fenómeno de adsorción consiste en la adherencia de las moléculas de gas a la superficie. En esto se funda el principio de la acción protectora de la careta antigás, en la cual hay una capa de carbón activado. Este carbón tiene una gran superficie específica. Las partículas de carbón activado son relativamente grandes, de hasta varios milímetros. Pero merced a un tratamiento especial ellas tienen una gran porosidad interna en forma de canales comunicantes.
De este modo, para una pequeña superficie específica exterior, determinada por las dimensiones geométricas de las partículas, ellos tienen una superficie específica interna muy grande, condicionada por la porosidad interna desarrollada. Por ejemplo, los carbones activados corrientes tienen una superficie específica de 500 m2 por 1 g. 20 g de este carbón tienen una superficie total igual a una hectárea.
La molécula de gas, al adherirse a la superficie, ocupa un área determinada. Si en un volumen cerrado se mide la presión del gas, y luego se introduce en este volumen polvo, la presión variará, por cuanto parte de las moléculas de gas se asentarán sobre la superficie de este polvo. Conociendo la variación de la presión en el sistema, la cantidad de polvo introducido y el área ocupada por una molécula sobre la superficie, se puede determinar fácilmente la superficie total del polvo.
Los métodos por adsorción proporcionan el valor de la superficie específica total-interna y externa. Pero en muchos casos, se necesita precisamente la superficie específica externa, la cual se determina por la grosura de los granos de polvo. Para medir únicamente la superficie específica externa, existiendo la porosidad interna de las partículas, los métodos por adsorción no son útiles. En un gran número de problemas, prácticamente importantes, las propiedades de los materiales se determinan por la grosura.
Como ejemplo de esto pueden servir los polvos abrasivos, incluyendo los de diamante, que se utilizan en la elaboración de los materiales.

Trayectoria de la molécula durante la difusión del polvo tal microscopio).
Los polvos de cemento, de metales para la metalurgia de polvos y los colorantes necesitan la característica de sólo la superficie específica exterior.
La mayoría de los métodos, que determinan la superficie específica exterior de los polvos, se basan en la medición de la resistencia que ejerce la columna de polvo al flujo de gas o líquido que pasa a través de ella. La utilización del flujo de líquido, por ejemplo, de agua, es menos racional, puesto que puede complicarse por la disolución de las partículas y otros motivos relacionados con su interacción con el líquido. La resistencia de la columna de polvo al paso del gas a través de sus poros, en el caso general, depende en forma complicada de la relación de la longitud media del recorrido de las partículas de gas de una colisión con otra molécula hasta la siguiente al claro medio de los poros. La ley de fluencia del gas a través de los poros se simplifica en el caso límite, cuando esta relación se hace mucho mayor que la unidad. La ley de fluencia del gas a través de los poros se simplifica, porque en este caso las moléculas de gas chocan entre sí con menor frecuencia que con las paredes de los poros.
Así pues, las distintas moléculas de gas se desplazan generalmente independientemente unas de otras, y el carácter quebrado de sus trayectorias se debe únicamente a las colisiones con las paredes de los poros. La trayectoria de las moléculas tiene la forma de una línea quebrada en zigzag. En este aspecto existe semejanza con el carácter desordenado de movimiento de las moléculas de sustancia disuelta, que chocan con las moléculas circundantes de disolvente. El propio movimiento desordenado representa una manifestación del movimiento térmico, la energía media del cual, como se sabe de la física, aumenta proporcionalmente a la raíz cuadrada de la temperatura absoluta. Tal movimiento desordenado de las moléculas disueltas, al existir una concentración irregular, conduce al transporte de la sustancia de la zona de mayor concentración de la misma a la zona de menor concentración. Gracias al movimiento desordenado de las moléculas el olor del perfume, vertido en un rincón del cuarto, al cabo de cierto tiempo, se nota en todo el local. En este caso el aire sirve de disolvente, y las moléculas (bastante grandes y complejas) se transportan por la esencia odorífera.
Si se examina la difusión de las moléculas de gas entre las partículas de polvo, cuando la presión es tan pequeña que las moléculas prácticamente no chocan entre sí, sino sólo con la superficie de las partículas, entonces se puede determinar la resistencia de la difusión. Cuanto más grueso es el polvo, tanto mayores son los huelgos entre las partículas, tanto con mayor facilidad transcurre el transporte de la sustancia. Este problema con la resistencia de la capa de polvo fue estrictamente resuelto por B. V. Deriaguin, quien halló la dependencia entre la resistencia de la capa de polvo y el tamaño de las partículas de polvo. A base de esto se ha elaborado una serie de instrumentos, que se utilizan con éxito en la industria. En los instrumentos, con ayuda de métodos simples, se mide la velocidad de transporte de la infiltración del gas a través de la capa de polvo, y luego se calcula la superficie específica.
En el caso de acrecimiento del diamante del medio carbonoideo, a lo cual nosotros volvemos de nuevo, preliminarmente se determina la superficie específica exterior de los polvos de diamante iniciales.
Así pues, la taza con el polvo de diamante se encuentra en el reactor. De todo el sistema se succiona el aire (el sistema se rarifica). El reactor comienza a calentarse y simultáneamente a través de él fluye, a la presión dada, el gas, por ejemplo, metano. Al cabo de determinados lapsos se mide la tracción del muelle, la cual muestra la variación del peso del cristal iniciador de diamante.
Como resultado de los experimentos se reveló una particularidad importante: la velocidad de crecimiento del diamante de los hidrocarburos es varias veces mayor que la de crecimiento del grafito en las mismas condiciones. Por la velocidad de desprendimiento de carbono a partir de la fase gaseosa todo el proceso puede ser dividido en tres etapas. Primero crece prácticamente sólo el diamante y la velocidad de desprendimiento de carbono es la máxima. Luego ella disminuye, por cuanto junto con el crecimiento del diamante comienza a formarse y a crecer el grafito. Por fin, la velocidad disminuye hasta el valor característico para la velocidad de crecimiento del grafito.
Curva de acrecencia de los polvos de diamante.
Los resultados del ensayo se pueden representar en forma de una gráfica en las coordenadas aumento del peso tiempo. Se obtendrá una curva, que partirá del origen de coordenadas y la convexidad de la cual estará dirigida hacia arriba. Si la velocidad de crecimiento del grafito fuera igual a la de crecimiento del diamante, entonces en dicha gráfica los puntos experimentales formarían una recta. Si la velocidad de crecimiento del grafito superase la de crecimiento del diamante, entonces la curva experimental tendría su convexidad hacia abajo.
Los numerosos ensayos ayudaron a establecer la velocidad de crecimiento del diamante en función de la temperatura y la presión, al principio para el metano y luego para otros hidrocarburos: etano, propano, etileno y acetileno. Los experimentos se realizaban en una instalación especial, en la cual el horno, fabricado de grafito, permitía obtener una temperatura de hasta 2.000 ºC. Ellos demostraron que el diamante puede crecer también a temperaturas de hasta 1.700-1.800 ºC.
Dado que junto con el crecimiento del diamante en los cristales iniciadores en medio gaseoso se separa también grafito, ha aparecido el problema de depuración del polvo obtenido del grafito. Claro está que no es necesario acrecentar sobre el diamante capas gruesas de grafito, para después tener que eliminarlo. Es racional librarse del grafito cuando éste todavía no cubrió totalmente la superficie de los cristales iniciadores de diamante. Las investigaciones, realizadas en el Instituto de Química Física, demostraron que las velocidades de gasificación del diamante y el grafito con oxígeno del aire (velocidades de oxidación) son distintas, con la particularidad de que la velocidad de oxidación del grafito es mucho más alta. Esto permitió elaborar el método de purificación de los cristales iniciadores de diamante del grafito mediante la oxidación en una corriente de aire. Se ha liquidado la necesidad de transportar el polvo acrecentado para su depurificación del reactor a la autoclave con hidrógeno, y después de la depuración, atrás. Todo el proceso de acrecimiento-depuración transcurría ahora en el reactor únicamente. Este método recibió el nombre de cíclico. Poco tiempo después él fue patentado también en otros países.
Con ayuda del método cíclico se logró acrecentar una cantidad de polvo inicial de 4,4 quilates (880 mg) en un 61% en 30 ciclos de acrecimiento-depuración (1,5 h en cada uno). Para comparar indiquemos que, con un polvo análogo, Eversole obtuvo un aumento relativo de peso muy próximo en 85 ciclos de acrecimiento-depuración (duración de cada ciclo formaba más de 6 h).
§. Zona cinética del crecimiento del diamante
Las minuciosas investigaciones permitieron a los científicos del Instituto de Química Física de la Academia de Ciencias de la URSS elaborar la teoría matemática del proceso de crecimiento conjunto del diamante y el grafito. La teoría explica excelentemente los resultados experimentales y se confirma por ellos. Ella encuentra también confirmación en los trabajos de los especialistas norteamericanos en el terreno de la síntesis del diamante de la fase gaseosa.
No obstante, esta teoría fue creada para las investigaciones realizadas con la condición de prácticamente igual concentración de metano inicial en toda la capa de polvo a acrecentar, y en el caso de acrecimiento de grandes cantidades de polvos de diamante esta condición puede ser perturbada. Ella se perturba porque hay que aumentar el espesor de la capa de polvo de diamante por consideraciones constructivas.
La velocidad de descomposición del metano es proporcional a la superficie, por eso el metano, penetrando en el interior de la capa de polvo de diamante, se gasta tanto más rápidamente, cuanto mayor es la superficie específica del polvo. Si el espesor de la capa de polvo es de todos los modos tan pequeño que, pese a la descomposición del metano, la concentración de éste .en todo el espesor es prácticamente igual, entonces la velocidad de crecimiento del diamante se determina por la velocidad de descomposición del metano, el factor cinético. Por lo tanto, el proceso transcurre en la zona cinética.
§. Zona de difusión de crecimiento del diamante
Si el espesor de la capa de polvo es mayor que el límite, que depende de la dispersión del polvo, la temperatura de la reacción y algunas otras magnitudes, entonces a cierta profundidad todo el metano ya se gasta y las capas más profundas del diamante no se acrecentarán. En este caso en las capas profundas la concentración de metano se distingue esencialmente de la concentración en la superficie y, por cuanto en el gas inmóvil (cuando no existe el mezclado forzado) el transporte de sustancia se realiza gracias a la difusión, el proceso de crecimiento del diamante transcurre en la zona de difusión. Esta zona está bien investigada por los científicos.
§. Distinción en el crecimiento del diamante y el grafito
Cuando comenzaron las investigaciones del crecimiento del diamante de la fase gaseosa, se suponía que los mecanismos de crecimiento del diamante y el grafito, si no son idénticos, son lo bastante próximos. Sin embargo, estas esperanzas no se justificaron. Resultó que el grafito y el diamante crecen de manera absolutamente distinta. Ante todo esto se nota en la influencia del hidrógeno. Al descomponerse el metano (y otros hidrocarburos) el hidrógeno es el producto de la reacción. La adición de hidrógeno al metano inicial disminuía esencialmente la velocidad de crecimiento del grafito, pero no desaceleraba la velocidad de crecimiento del diamante. Se creaba la impresión de que la velocidad de crecimiento del diamante al añadir hidrógeno incluso aumentaba. ¿De qué modo se realizaban estas investigaciones?
En la taza con el polvo de diamante se introducían dos contactos de grafito y se medía la resistencia eléctrica entre ellos. Por cuanto el diamante es dieléctrico, y el grafito, conductor, a medida que se separa el grafito sobre los polvos de diamante disminuye la resistencia del espacio entre electrodos. La distancia entre los electrodos estaba fijada, el polvo de diamante se tomaba de una misma granulación. Por consiguiente, la magnitud de la conductibilidad dependía únicamente de la cantidad de grafito precipitado. Después del experimento el polvo se pesaba. Luego, alejando el grafito, se podía determinar la cantidad de diamante acrecentado.
En determinadas condiciones, al diluir el metano con hidrógeno, disminuía la cantidad de grafito separado, y aumentaba la cantidad de diamante. Crecía incluso el aumento de peso en el polvo de diamante iniciador-de diamante y grafito juntos. Parecía que se alteraba el principio de le Chatelier, conforme al cual la adición de producto de la reacción frena a esta última. No obstante, el principio quedó inalterable. En realidad al añadir hidrógeno disminuyen las velocidades de crecimiento tanto del diamante, como del grafito. Disminuye el bloqueo de las partículas de cristales iniciadores por el grafito. Pero, como la velocidad de crecimiento de los diamantes de los hidrocarburos supera considerablemente la velocidad de crecimiento del grafito y la parte de superficie, sobre la cual puede crecer el diamante, aumenta, entonces incrementa también la velocidad total de su crecimiento.
Las distinciones de los mecanismos de crecimiento del diamante y el grafito se manifestaron de manera particularmente sorprendente al investigar el fraccionamiento (separación) de los isótopos estables del carbono.
El carbono tiene dos isótopos estables: con un peso atómico 12-C12 y con un peso atómico 13-C13. Las investigaciones geoquímicas demostraron que en la naturaleza todos los minerales que contienen carbono (a éstos pertenecen el diamante y el grafito) tienen una relación determinada entre estos dos isótopos. Los diamantes naturales isotópicamente son “más pesados” que el grafito natural, es decir, ellos contienen relativamente mayor cantidad de isótopo pesado de carbono C13. Es más, en las chimeneas de kimberlita Los diamantes son isotópicamente “más pesados” que los carbonatos de las rocas circundantes.
El diamante, sintetizado por los métodos de altas presiones, hereda la composición isotópica del grafito que se utiliza para la síntesis. Al crecer del metano, el diamante que se forma se hace isotópicamente “más pesado” que el grafito que crece. El diamante elige del metano (en el cual también existe una relación determinada de C12 y C13) mayor cantidad de isótopo pesado de carbono, mientras que el grafito utiliza principalmente el isótopo ligero.
Es absolutamente natural enlazar estos efectos del enfoque individual del diamante y el grafito con respecto a la elección de los isótopos con los distintos mecanismos de crecimiento de estas formas de carbono.
Se observan unos fenómenos interesantes al investigar el crecimiento del diamante de las mezclas de distintos hidrocarburos. La velocidad de crecimiento del grafito de la mezcla de metano a 0,1 mm Hg y de etano a 0,1 mm Hg es igual a la suma de las velocidades de crecimiento del grafito de los gases por separado para la misma presión. La velocidad de crecimiento del diamante de esta mezcla será menor que la suma de las velocidades de crecimiento de los componentes por separado para las mismas presiones parciales.
Esto se explica por los distintos mecanismos de crecimiento del grafito y el diamante.
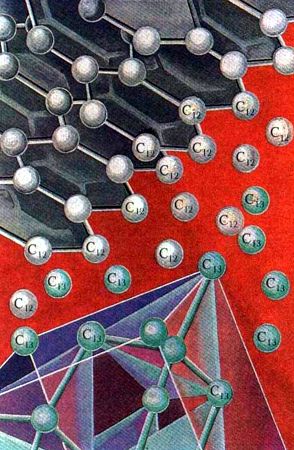
Diferencia en el crecimiento del diamante y el grafito de la fase gaseosa Al cristalizarse simultáneamente en el diamante resulta relativamente más isótopo de- carbono C13, mientras que en el grafito C12.
Se puede suponer que el grafito crece en capas lisas, paralelas a la superficie del cristal iniciador, a partir de las moléculas de hidrocarburo que se encuentran en la superficie y que caen en la zona de crecimiento de la fase gaseosa. Cuanto mayor es el grado de cubrimiento de la superficie por las moléculas de hidrocarburos, tanto más intensivo es el crecimiento del grafito.
El grafito puede formarse sólo de un gran número de moléculas de metano (o de otro hidrocarburo) que se encuentran directamente en la superficie. Pero, cuanto mayor parte de superficie está ocupada por el hidrógeno, tanto menor cantidad de moléculas de hidrocarburo se encontrarán en ella. El diamante crece únicamente en la parte de la superficie del cristal iniciador, que se encuentra libre de moléculas de hidrocarburos. Pero él puede también formarse en la superficie cubierta de átomos de hidrógeno. Por esta razón, la dilución, por ejemplo, del metano con hidrógeno aumenta la velocidad de crecimiento del diamante y disminuye la de crecimiento del grafito.
En los límites de estas nociones (expuestas, naturalmente, bastante esquemáticamente) encuentran su explicación las distinciones observadas de la cristalización del diamante y del grafito.
Así, a bajas presiones crece el polvo de diamante. ¿Y es posible en estas condiciones la síntesis de los cristales de diamante de otra forma?
Capítulo 9
Crecimiento de las películas y cristales de diamante a bajas presiones
§. Obtención de las películas de diamante
Uno de los primeros métodos patentados de la síntesis de las películas de diamante, con participación de las reacciones químicas, incluía en sí el calentamiento electrónico. Sobre el soporte se dejaba pasar un gas carbonífero. Un dispositivo especial (parecido al dispositivo de los tubos de rayos catódicos empleados en los televisores) creaba un haz electrónico que corría por la superficie del soporte. Este haz calentaba el soporte en el lugar de contacto con éste (en estos casos se habla del calentamiento local). El haz electrónico pasaba muchas veces por la superficie del cristal y, como resultado, se formaba una película fina de diamante.
Existen datos que comunican acerca del crecimiento de las películas de diamante del flujo de átomos de carbono. Por uno de los métodos el grafito se calienta hasta 4000 ºC. A esta temperatura él comienza a evaporarse y los átomos de carbono del grafito se precipitan sobre el cristal iniciador de diamante. Se ha logrado también obtener películas de diamante del flujo de átomos de carbono generados en el arco de carbón. En este caso entre el soporte y la fuente de átomos de carbono se crean campos eléctricos y magnéticos. De este modo se puede sintetizar películas de diamante prácticamente en cualesquiera superficies.
En el Instituto de Química Física de la Academia de Ciencias de la URSS las películas de diamante primero se acrecentaban sobre cristales, así como se formaban los polvos de diamante. Además, D. V. Fedoséev, B. V. Spitsin y V. P. Varnin, para establecer si existe o no aumento de peso del nuevo diamante, tuvieron que realizar más de una decena de experimentos. Los diamantes acrecentados (mejor dicho, su superficie) fueron investigados por ellos en un microscopio electrónico a la luz. Los electrones, para las energías utilizadas en estos microscopios, no pueden pasar a través de las muestras con gran espesor.

La superficie del diamante sintetizado con un gran aumento al microscopio. El diamante primero crece no por toda la superficie, sino solo en algunas de sus partes.
Este último no debe superar mil Angstroms, y en los experimentos se utilizaban cristales de diamante de varios milímetros de espesor.
Para la investigación del cristal se tuvo que preparar las llamadas réplicas. Para ello sobre su superficie se aplicaba una fina película de colodión. Después de que se enfriaba, se quitaba, obteniendo una réplica monoescalonada. Allí, donde en la superficie del cristal había saliente (cavidad), en la réplica se formaba una cavidad (saliente).
No obstante, la réplica de colodión se disipaba al calentarse, ella era quemada por el rayo del microscopio electrónico. Por eso sobre la primera réplica se espolvoreaba una capa fina de grafito. Después de disolver el colodión en el correspondiente disolvente, la película de grafito la réplica biescalonada, se colocaba en el portaobjeto del microscopio electrónico y se investigaba. Gracias al distinto grado de absorción de los electrones en los distintos espesores, en la pantalla fluorescente del microscopio se ve el cuadro correspondiente a la estructura de la superficie del objeto que se investiga, o sea, en el caso dado, de la réplica biescalonada. Aquí se puede hablar sobre la analogía directa con la fotografía, lo único que el papel de negativo lo cumple la propia réplica.
Las investigaciones han demostrado que el diamante crece al principio no por toda la superficie del cristal iniciador, sino sólo en algunos de sus sitios. En general los gérmenes cristalinos de la nueva fase se forman en las secciones de la superficie, más activas desde el punto de vista químico, por ejemplo, en todo tipo de escalones, los cuales son muchos en la superficie de un cristal real. Así, al crecer un nuevo diamante (en la etapa inicial) sucede precisamente la revelación de la estructura real de la superficie del cristal. La revelación de la estructura real de la superficie del cristal formando sobre ella microcristales de otras sustancias lleva el nombre de decoración.
Poco a poco sobre la superficie del cristal se forman cada vez mayor número de películas pequeñas de diamante-esto es la segunda etapa de crecimiento. Luego, en la tercera etapa, ellos se funden, formando un frente único de cristalización. Las investigaciones estructurales especiales han demostrado que la capa acrecentada de diamante prácticamente no se distingue en nada del soporte.
§. Método de acrecimiento del diamante por impulsos
Así como en la síntesis de otros cristales de diamante ya examinados, cuanto menor es la velocidad de crecimiento, tanto de mejor calidad (más perfecta) se obtiene la película de diamante. Al contrario, al aumentar la velocidad de crecimiento su estructura empeora. Ordinariamente, al suministrar rápidamente el material de construcción, sobre los cristales iniciadores se deposita el grafito. Este debe ser alejado para continuar el crecimiento del diamante. Para esta finalidad se emplean los métodos en húmedo, por ejemplo, los cristales se hierven en ácido perclórico. Éste hierve y se descompone con desprendimiento de oxigeno elemental, a esta temperatura, prácticamente no interacciona con el diamante, pero con mucho gusto gasifica el grafito. Una vez depurados del grafito, los cristales se lavan con agua destilada, se secan, se pesan y se meten en el reactor.
Pero, sin embargo, la depuración de los cristales iniciadores es una operación adicional en el proceso. ¿No se puede acaso prescindir de ella?
Los esfuerzos de los investigadores estaban dirigidos a la elaboración del método de crecimiento del diamante que permita evitar la aparición del grafito. Como resultó, esto puede ser logrado por varios métodos. El primero históricamente fue el llamado método por impulsos, propuesto por B. V. Deriaguin y D. V. Fedoséev. Este método consiste en lo siguiente. Sea que el material de construcción, es decir, los átomos de carbono, se suministran a la superficie de la faceta de diamante con exceso, pero en el transcurso de un tiempo muy corto. Como resultado de la alta sobresaturación, además del crecimiento autoepitaxial del diamante puede transcurrir la formación de los gérmenes cristalinos de grafito. Si después de esto llega una pausa o el suministro de material de construcción se realiza lentamente, entonces debido a la “saturación incompleta” que surge, los gérmenes cristalinos de grafito, haciéndose subcríticos, pasan de nuevo a la fase gaseosa. El grafito puede, por ejemplo, asociándose a los átomos del hidrógeno presente, formar moléculas de metano.
La transición de los átomos de la superficie del diamante a la fase gaseosa está dificultada por el enlace autoepitaxial más resistente con ella.
Al alternarse reiteradamente los impulsos de sobresaturación y las pausas se acrecentará sólo la capa de diamante.
Método de acrecencia del diamante por impulsos. Arriba un horno óptico un reactor en forma de esfera. Abajo a la izquierda, sistema de vacio sobre un soporte
Los experimentos del método por impulsos de la síntesis se realizaban en una instalación que constaba de un horno óptico y un reactor de cuarzo. El horno óptico representa un dispositivo en el cual la radiación de una potente lámpara de xenón de alta presión se fijaba en el objeto de investigación. Con su ayuda las muestras se calentaban hasta 3.500 ºC. El reactor de cuarzo tenía la forma de una esfera. En el centro del reactor, en un medio carbonoideo, se colocaba el cristal iniciador de diamante. Este último se fijaba con ayuda de sujetadores de renio de agujas. El renio hasta los 2.000 ºC prácticamente no interacciona con el carbono y no forma carburos. El reactor, conectado al sistema de vacío, se colocaba sobre un soporte capaz de desplazarse en tres direcciones mutuamente perpendiculares. La temperatura se regulaba variando la posición del cristal con respecto al foco del horno óptico.
Los impulsos de calentamiento se creaban girando un disco con ranuras, que interrumpía los rayos de la lámpara de xenón. Variando la velocidad de rotación, el número y la longitud de las ranuras, se podía regular en amplios límites la longitud de los impulsos y la duración de las pausas entre ellos.
Los experimentos realizados especialmente dieron unos resultados interesantes. Resultó, que la temperatura de la superficie del diamante durante el impulso de calentamiento mediante la iluminación alcanza 2.500 ºC, pero el diamante no se grafitizaba. Esto sucede por dos causas: en primer lugar, el tiempo de su calentamiento era muy corto (constituye cerca de una centésima de segundo); en segundo lugar, se reveló que en un medio que contenía carbono, incluso el cristal de diamante calentado no se grafitizaba hasta unas temperaturas muy altas. De este modo, la velocidad de reacción se elevaba esencialmente, y el grafito no se separaba.
Mediante el método por impulsos se obtuvieron películas de diamante de hasta 12 a 15 μ de espesor. Por sus propiedades ellas no se diferenciaban del diamante soporte y eran su continuación. Desgraciadamente el crecimiento del diamante le estorbaba una circunstancia -su propia propiedad.
Para el calentamiento del cristal, mejor dicho, de su superficie, hasta una temperatura alta es necesario que él absorba la radiación. Pero los cristales de diamante, al contrario, dejaban pasar bien la luz visible, el flujo de la cual creaba principalmente la lámpara de xenón. Fue necesario elaborar antes del experimento la superficie del cristal, hacerla mate y capaz de absorber parte de los rayos. Como resultado aumentó el calentamiento.
No obstante, a medida que crecía el diamante disminuía la rugosidad inicial, y al fin de cuentas el diamante se volvía nuevamente transparente. El ya no se calentaba más y cesaba su crecimiento.
Para evitar la separación del grafito durante el crecimiento del diamante, además del método por impulsos, se puede utilizar la distinta capacidad de los gases para la interacción con las distintas formas del carbono. Ya fue señalado que, por ejemplo, el diamante se gasifica débilmente por el hidrógeno elemental, mientras que el grafito se decapa fácilmente por él. Si se crea un medio, en el cual se pudiera separar el carbono, y el grafito se decapara, entonces crecería solamente el diamante.
Los científicos norteamericanos propusieron utilizar tales metales como el platino y el paladio. Ellos contribuyen a la formación de hidrógeno elemental de su molécula. Existen también otros métodos de obtención del hidrógeno elemental.

Proceso de acrecencia de la superficie del cristal (al microscopio)
Pero entonces se pierde la necesidad del soporte de diamante: los gérmenes cristalinos de diamante pueden formarse también fuera de éste. Pero el proceso de formación del diamante es, no obstante, menos probable que la formación de los gérmenes cristalinos de grafito, pese a que si se alejan éstos (se gasifican), entonces crecerá sólo el diamante. La realización de este proceso permitió sintetizar películas de diamante sobre metales y semiconductores, así como formar cristales separados de diamante, por ejemplo, sobre un soporte de cobre.
Al lector le puede surgir la pregunta natural: ¿se puede en general prescindir del soporte sólido para obtener diamante directamente de la fase gaseosa, por ejemplo, a partir de hidrocarburos, a semejanza a como se obtienen miles de toneladas de negro de carbón? Efectivamente, hablando en rigor, durante la descomposición, por ejemplo, del acetileno debe obtenerse grafito, y no negro de carbón, porque el grafito es una forma de carbono más estable. No obstante, el negro de carbón de acetileno se obtiene en gran cantidad y se emplea como relleno para las gomas (principalmente para las cubiertas de ruedas de automóviles).
De la teoría, que examina la formación de gérmenes cristalinos de distintas modificaciones cristalinas de una misma composición química, se desprende que a cada modificación le corresponde su zona de sobresaturaciones, cuando la probabilidad de su formación es la máxima. Para el diamante ésta es la zona de sobresaturaciones muy altas, las cuales pueden ser realizadas a altas temperaturas en un gas lo suficientemente denso. Se puede imaginar el siguiente experimento, por ahora hipotético. La potente radiación de un láser se concentra instantáneamente dentro de un líquido. En este punto surge una ruptura de láser, análogamente a la chispa eléctrica. El hidrocarburo líquido pasa al estado gaseoso. Se forma un poro, en el cual en el momento inicial la temperatura y presión son suficientemente altas, para que puedan formarse diamantes.
§. Cristales filiformes de diamante bigotes de diamante
Al investigar el método por impulsos de crecimiento del diamante los colaboradores del Instituto de Química Física B. V. Deriaguin, D. V. Fedoséev, V. M. Lukianovich, B. V. Spitsin, V. A. Riábov y A. V. Lavréntev descubrieron cristales filiformes de diamante. Este acontecimiento se encuentra incluido en el registro de los descubrimientos de la URSS.
Ya sabemos que si el suministro del material de construcción a la faceta en crecimiento se realiza lo suficiente lentamente (la sobresaturación de los átomos de carbono cerca de ésta :no es muy alta) el cristal en el proceso del crecimiento lento conserva la estructura monocristalina. Se separan sucesivamente capas de un átomo de espesor, que continúan la estructura del soporte, y la mampostería de la nueva capa se demora hasta la finalización de la antecedente. La demora sucede porque la pequeña isla de la nueva capa es tan inestable como lo es el germen cristalino subcrítico y a él le hace falta tiempo para determinarse. Durante el tiempo de demora a la capa anterior le da tiempo a formarse por completo.
Si el material de construcción se suministra demasiado rápidamente, se reduce la demora de la formación de la nueva capa. Ésta comienza a crecer antes de finalizar la mampostería de la anterior. El relieve del cristal pierde su lisura y su estructura deja de doblar la estructura del soporte. Al fin de cuentas la capa creciente se hace policristalina, es decir, está compuesta de muchos cristales diminutos.
No obstante, suele suceder que en algunos lugares de la superficie de la faceta cristalina el crecimiento transcurre sin retardo alguno, pero al mismo tiempo sin estropear la estructura monocristalina incluso a grandes velocidades de crecimiento. Como resultado en los respectivos lugares crecen cristales filiformes o whisker que en inglés significa (“bigote”) con una estructura muy perfecta. Estos cristales de hasta 1 a 2 mm de largo fueron obtenidos por el método por impulsos en el curso de 5 h aproximadamente.
Los cristales filiformes se llaman a veces materiales del futuro. Ellos poseen unas propiedades únicas: estructura perfecta, capacidad para conservar la elasticidad a altas temperaturas, y lo principal, alta resistencia, próxima a la teórica.

Crecimiento de los cristales filiformes de diamante, bigotes de diamante. Ellos poseen propiedades únicas: una estructura perfecta, capacidad para conservar la elasticidad a alta temperatura, y alta resistencia.
La resistencia teórica del material se determina por el carácter y la fuerza de enlace entre los átomos. Sin embargo, en los materiales utilizados corrientemente la resistencia está muy lejos de la teórica, puesto que con la presencia de los distintos defectos en su estructura, por ejemplo, grietas rudimentarias, ella se reduce considerablemente. Comparen: la resistencia a la rotura del hierro ordinario es igual a 18 a 23 kg/mm2, es decir, es suficiente aplicar un esfuerzo de 23 kg por 1 mm2 para destruir este metal; la resistencia de los cristales filiformes de hierro de 2 μ de diámetro y 2 mm de largo alcanza 1300 kg/mm.
Gracias a sus propiedades los cristales filiformes y los materiales fibrosos se emplean cada vez más ampliamente en la técnica moderna en los conjuntos más cargados de las máquinas y aparatos. Así, los cristales filiformes de zafiro, que arman el niobio {un 50% en peso) aumentan (en comparación con el niobio puro) la resistencia del artículo 4 veces, reduciendo al mismo tiempo el peso. Este hecho tiene gran importancia para la construcción de aparatos para las naves espaciales. Al armar las fibras se crea una carcasa relativamente rígida, la cual soporta la carga principal. La ligadura no sólo une las fibras, sino que también las protege contra la solicitación del medio ambiente.
Los cristales filiformes se llaman a veces bigotes porque pueden crecer muy espesamente, incluso con mayor densidad que los bigotes naturales. Por cuanto muchos materiales fibrosos en las composiciones se fijan mal con la ligadura, para aumentar la adherencia en ellos se precipitan pequeños cristales filiformes. Este proceso se llama con frecuencia “erizamiento" o “whiskerización”.
El descubrimiento de los cristales filiformes de diamante, o los bigotes de diamante, tiene gran importancia. Por primera vez el hombre ha obtenido cristales filiformes de sustancia metaestable en las condiciones de la síntesis. Además el crecimiento del diamante transcurría a bajas presiones, pero con velocidades lineales muy grandes. El cristal filiforme crecía a la velocidad de hasta 0,25 mm por hora. Esta velocidad es mucho mayor que la de crecimiento de los polvos de diamante, la cual raramente supera varias decenas de Angstroms por hora.
Los cristales filiformes de diamante representan fibras largas, con frecuencia retorcidas y encorvadas. Las investigaciones de los cristales demostraron que ellos tienen una estructura perfecta, a pesar de su rápido crecimiento. Los cristales en crecimiento pueden atrapar impurezas y colorearse. Así, las impurezas de cobre le dan al bigote de diamante un color azul. Ordinariamente la longitud de los bigotes no excedía de 100 a 200 μ, pero a veces crecían bigotes “récord” de 2 mm de longitud.
Los primeros cristales filiformes de diamante fueron obtenidos por los científicos haciendo uso del método por impulsos. Luego se obtuvieron también por otros métodos; fueron sintetizados a altas presiones, cultivados en el microscopio electrónico.
En el Instituto de Química Física de la Academia de Ciencias de la URSS se realizó una observación interesante. El crecimiento de los cristales filiformes de diamante se organizó de tal modo que, haciendo uso del microscopio, se podía observar la superficie del cristal inmediatamente durante el experimento. Así, en uno de los experimentos los investigadores descubrieron un cristal filiforme que crecía. Pronto, sin embargo, su crecimiento a lo largo cesó y él comenzó a aumentar su grosor. Después del experimento resultó que eso era un pequeño cristal de diamante-el único monocristal de cerca de 0,1 mm de diámetro con facetado claramente expresado. Tales formaciones monocristalinas se encontraron luego con frecuencia durante la cristalización por impulsos del diamante.

Cristales isométricos de diamante. En la superficie del cristal iniciador a veces, junto con los cristales filiformes, crecen cristales deforma esférica.
Naturalmente que es seductora la idea de crecer a gran velocidad no un bigote, sino un cristal entero y hacerlo crecer hasta un tamaño muy grande. Pero, por ahora, esto es imposible: los mecanismos de crecimiento de los cristales filiformes y las facetas de diamante se diferencian en mucho.
§. Bigotes de grafito
Entre todos cristales filiformes conocidos el más continuo es el bigote de grafito. Qué extraño, es que el grafito, tan frágil con los lápices de grafito se escribe, posee una resistencia muy alta. Si, efectivamente. Pero es que en los bigotes de grafito los planos básicos del grafito, por los cuales se desintegran sus pedacitos y dejan la huella al escribir con lápiz, están dirigidos a lo largo del bigote. Si, por ejemplo, se toma un paquete de papel, es fácil cerciorarse de que una hoja respecto a otra se desplaza fácilmente. Esto será cierto modelo del grafito de lápices. Pero enrollen varias hojas en un tubo lo más compactamente posible. Se obtendrá un modelo alejado del cristal filiforme de grafito. Y es dudoso que ustedes logren romper este tubo de papel.
Semejantemente a este modelo, poseen también una gran resistencia a la rotura los cristales filiformes de grafito. Los cristales de 1 p de diámetro tienen una resistencia a la rotura de cerca de 1.500 kg/mm2.
Los bigotes de grafito asombran por la variedad de sus formas. Ellos pueden ser rectos, en forma de bambú con cavidades en el interior, encorvados, formar una espiral derecha e izquierda. La diversidad de formas de los cristales está relacionada con la condición de su obtención.

Whiskerización de las fibras de grafito la superficie de la fibra de grafito: cubierta de numerosos cristales filiformes de grafito
Las llamadas fibras de grafito, obtenidas mediante la grafitización de las fibras poliméricas a altas temperaturas, no ceden mucho por su resistencia a los bigotes de grafito. De las fibras se fabrican tejidos que poseen una gran resistencia a la rotura y a las altas temperaturas.
Además del diamante, el grafito y sus modificaciones son posibles también otras formas del carbono. Así, los científicos soviéticos (A. M. Sladkov, V. V. Korzhak, Yu. P. Kudriávtzev y V. I. Kosátochkin) descubrieron una nueva forma del carbono, el carbín. Si el diamante se caracteriza por estructura volumétrica y el grafito, por la lamelar, el carbín representa una estructura de cadena. Propiedades de esta modificación del carbono no están del todo estudiadas, y aquí son posibles interesantes descubrimientos.
Nos hemos familiarizado con la síntesis de los monocristales de diamante. Pero en la naturaleza se encuentran también diamantes policristalinos. ¿Elaboran los científicos los métodos de su obtención artificial?
Capítulo 10
Materiales policristalinos de diamante
§. Materiales policristalinos sintetizados
Los diamantes del tipo de bailas y carbonado que se encuentran entre los diamantes naturales son formaciones policristalinas. Corrientemente éstos están compuestos de pequeños monocristales de diamante, unidos entre sí. Para la aplicación en la técnica los materiales policristalinos en ciertos casos son preferibles, por cuanto ellos (a diferencia de los monocristales) son isótropos, es decir, sus propiedades son iguales por distintas direcciones. Tienen particularmente buena perspectiva los materiales policristalinos extraduros. Ellos pueden sustituir los diamantes monocristalinos prácticamente en todas las herramientas, incluso en aquellas en las cuales se usan grandes monocristales naturales de diamante: en las herramientas de perforación, cuchillas y en las hileras.
Los diamantes naturales del tipo carbonado representan un agregado de diminutas partículas de diamante. Las dimensiones de estas partículas oscilan entre fracciones de micrón y decenas de micrones. Los carbonados naturales tienen cierta porosidad debida a los espacios entre las partículas, por eso su densidad es menor que la densidad de los monocristales de diamante y constituye de 3,1 a 3,4 g/cm3.
En la actualidad los materiales policristalinos artificiales extraduros pueden ser obtenidos por dos procedimientos: inmediatamente durante la síntesis o mediante la aglutinación de los polvos de diamante.
Para sintetizar el carbonado artificial es necesario que se formen muchos cristales pequeños, los cuales, antes de alcanzar unas dimensiones considerables, deben unirse entre sí. Este problema fue resuelto por un grupo de colaboradores del Instituto de la Física de Altas Presiones de la Academia de Ciencias de la URSS bajo la dirección de L. F. Vereschaguin del modo siguiente. El grafito, en presencia de metal, se sometía a presión (por lo menos de 80 kilobar) a una temperatura de cerca de 1200 ºC. Por cuanto a altas presiones la transformación del grafito en diamante transcurre con el desprendimiento de calor -el calor de cristalización para acelerar el proceso y, por consiguiente, aumentar los cristales que se forman era necesario extraer el calor desprendido. Con esta finalidad en el interior del cilindro de grafito se introducía una varilla metálica, los extremos de la cual se encontraban en contacto con los sectores refrigerados de los punzones. Para obtener después de la síntesis un aglomerado policristalino de diamante de determinada forma se podía utilizar un modelo pieza bruta de grafito de la forma requerida. Este modelo simplemente debía ser calculado tomando en consideración la contracción durante la transformación del grafito en diamante.
Además del carbonado artificial en el Instituto de la Física de Altas Presiones se sintetizaron también diamantes del tipo bailas. Éstos tienen una disposición radial de los granos de diamante y se cristalizan en forma de esfera.
El bailas y carbonado artificiales, por su resistencia, no ceden en nada a los diamantes naturales. Así, las coronas de perforación de carbonado sintético triturado, por su capacidad de trabajo, incluso superan a las de diamantes naturales.
A decir verdad, cabe, no obstante, señalar que para el trabajo en condiciones de rocas geológicas particularmente pesadas se siguen utilizando diamantes naturales o materiales a base de los mismos. Esto está relacionado no con las propiedades de los carbonados sintéticos, sino, quizás, con los métodos de fabricación de la herramienta de perforación empleados actualmente. La matriz, en la cual se introducen los diamantes, se hace de metales de bastante alta temperatura de fusión, por lo tanto, para la fabricación de las coronas se requiere un calentamiento duradero a temperaturas muy altas. Los carbonados sintéticos incluyen en sí una cantidad considerable de impurezas de metales, que se utilizan durante la síntesis del diamante. Durante el calentamiento estas impurezas interaccionan con los granos de diamante y el material policristalino pierde su resistencia. Desgraciadamente, al enfriarse su resistencia no se restablece.
La relativamente baja termorresistencia del carbonado sintético, es decir, la disminución de su resistencia después de su calentamiento, obligó a los científicos a buscar nuevos métodos de obtención de materiales policristalinos con alta termorresistencia.
En este terreno el único camino es la aglutinación de los pequeños polvos de diamante a altas temperaturas. Sobre esta posibilidad ya escribía O. I. Leipunski en sus trabajos del año 1939.
§. Materiales de diamante aglutinantes.
Estos se llaman habitualmente conjuntos compactos o productos aglomerados, por cuanto durante la aglutinación a altas temperaturas se forman muestras compactas. Prácticamente todos los métodos de preparación de los conjuntos compactos prevén el empleo de aglutinante metálico o de carburo. Es que la deformación del diamante es insignificante incluso a presiones y temperaturas muy altas, y para obtener un material de alta solidez y resistencia al desgaste es necesario llenar las cavidades entre los granos de diamante.
Al calentar la mezcla de polvo de diamante con polvo del material aglutinante, ella debe fundirse e interaccionar con el diamante formando carburos. Solamente cuando entre el diamante y el aglutinante existe una capa de transición, que es químicamente activa tanto con respecto al diamante, como al aglutinante, el conjunto compacto que se obtiene posee una alta resistencia. Por consiguiente, una condición importante del buen trabajo del aglutinante es su interacción química con el diamante.
Al elegir el material del aglutinante el investigador se encuentra ante un dilema. Por una parte, es deseable tomar para él un material que se funda a temperaturas relativamente bajas. Esto es más conveniente desde el punto de vista de la ingeniería. No obstante, por otra parte, los productos aglomerados con tal aglutinante no soportan cargas intensas, por ejemplo, durante el corte, por cuanto al elevar la temperatura el aglutinante se ablanda. Además, los aglutinantes de baja temperatura de fusión, como regla, tienen pequeña dureza. ¿Posiblemente, merece la pena emplear en calidad de aglutinantes los boruros, carburos y nitruros de alta temperatura de fusión? Pero, semejantes materiales, que poseen alta dureza, ellos mismos se deforman mal, por lo cual llenan mal los poros en el proceso de aglutinación. Además, los conjuntos compactos a base de diamantes y carburos, nitruros y boruros de alta temperatura de fusión poseen elevada fragilidad. En la práctica estos productos aglomerados se usan muy raramente. Por lo menos, no existen datos fidedignos sobre su utilización.
Tiene mucha importancia elegir correctamente la cantidad de aglutinante necesaria para la aglutinación. Efectivamente, si hay poco aglutinante, los poros entre los granos de diamante se quedan sin llenar. Si la cantidad de aglutinante es excesiva, entonces el material del aglutinante forma aglomeraciones que, naturalmente, no pueden trabajar como material extraduro. Este problema se resuelve graciosamente por el método, elaborado en el Instituto de la Física de Altas Presiones, de obtención del nuevo material, el producto aglomerado, llamado almet. El aglutinante metálico se encuentra fuera del polvo de diamante, pero en contacto con éste. Bajo la acción de la alta presión tiene lugar el prensado del polvo de diamante y al elevar la temperatura se funde el metal. Las fuerzas capilares le “obligan” a impregnar el sistema poroso de granos de diamante. En los poros entra justamente tanto metal, cuanto en ellos cabe. No hay ni insuficiencia de aglutinante ni exceso del mismo, como resultado el almet dispone de buenas propiedades de explotación.
Naturalmente que no todos los metales o aleaciones pueden ser utilizados en la preparación del almet. Son útiles únicamente aquellos que mojan bien el diamante. Es interesante señalar que si se mezcla el polvo de diamante con polvo de cobre, que no moja el diamante, durante la aglutinación todo el cobre saldrá del polvo y formará una capa en la superficie límite del producto aglomerado de diamante.
Claro está que el mejor aglutinante para unir los granos de diamante en un producto único compacto seria el propio diamante. Pero, para que el diamante se deforme y llene todos los poros, se requieren unas presiones y temperaturas muy altas. La técnica moderna permite obtener dichas presiones y temperaturas, sin embargo, por desgracia, en este caso las matrices de alta temperatura de fusión (los dispositivos para crear altas presiones) quedan tan rápidamente fuera de servicio, que la cosa no merece la pena. Efectivamente, en resumidas cuentas, el diamante está destinado para sustituir la aleación dura en la herramienta de corte, y durante la aglutinación del diamante se gasta una cantidad demasiado grande de esta aleación dura, por lo tanto, este proceso no es ventajoso.
Pueden proporcionar cierta reducción de los parámetros de la aglutinación los diferentes subterfugios: la introducción de adiciones especiales (¡no aglutinantes!), el tratamiento preliminar de los polvos de diamante.
Transformación en diamante, de finas capas de grafito intercaladas entre los cristales de diamante.
Conforme a la tecnología, elaborada en el Instituto de Metales de Alta Temperatura de Fusión y Aleaciones Duras de la Unión Soviética, los polvos de diamante natural y sintético se calcinan preliminarmente a la temperatura de 500 a 600 ºC y luego, en presencia de adiciones a base de compuestos de metales alcalinotérreos (cal, fluorita, creta, talco) se aglutinan a la presión de 120 a 170 mil at y a la temperatura de 2700 a 3700 ºC, no más de 2 s. Los productos aglomerados que se obtienen en este caso llevan el nombre de CB (SV). Éstos se aplican en la fabricación de cuchillas. Los conjuntos policristalinos compactos SV se utilizan también en las coronas de perforación.
Desgraciadamente, estos conjuntos compactos se aglutinan a presiones muy altas y temperaturas correspondientes a la curva de equilibrio de fases, lo que también aumenta el gasto de aleación dura, por eso las posibilidades de obtener grandes conjuntos compactos son muy limitadas.
El nuevo método de obtención de conjuntos compactos de diamante a presiones no mayores de 80 mil at fue elaborado por el Instituto de Química Física de la Academia de Ciencias de la URSS y el Instituto de Materiales Extraduros de la Academia de Ciencias de la URSS. Su idea fundamental consiste en las transformaciones de fase de las capas finas de grafito, aplicadas sobre la superficie del diamante. Es conocido que la superficie del cristal-soporte influye esencialmente en las propiedades de las capas finas aplicadas sobre ella. Conforme a los datos de los cálculos de los especialistas, la capa fina de grafito, comprimida entre dos cristales de diamante, se transformará en diamante a presiones considerablemente más bajas, que las que corresponden a la curva de Leipunski. El efecto de la reducción de la presión de la transición de fase disminuye al aumentar el espesor de la capa de grafito, y en el límite, para un espesor considerable, es igual a cero. Con otras palabras, las capas gruesas de grafito se someten totalmente a la dependencia conocida de Leipunski.
Además de la reducción de la presión, necesaria para la transición grafito-diamante, en las capas finas se hace más fácil el proceso de reconstrucción colectiva de la estructura, lo que permite al grafito transformarse en diamante en un plazo muy corto, en varios segundos.
El proceso de obtención de los conjuntos compactos de diamante consta de dos etapas. En la primera etapa el polvo de diamante se acrecienta de la fase gaseosa, con la particularidad de que deben formarse no sólo las capas acrecentadas de diamante y de diamante-grafito, sino que también una capa de puro grafito. En la segunda etapa el polvo acrecentado se aglutina en la zona de estabilidad del diamante. Las presiones de aglutinación son relativamente moderadas, por eso surge la posibilidad de obtener conjuntos compactos de hasta varios quilates. Al nuevo material se le dio el nombre de carbonita, puesto que él no contiene nada más que carbono. La carbonita goza de alta termorresistencia, es decir, no pierde su resistencia después del calentamiento a altas temperaturas, por cuanto ella no contiene inclusiones ajenas.
Los ensayos de la carbonita en las cuchillas para elaborar metales no ferrosos y aleaciones duras demostraron su alta resistencia, garantizando al mismo tiempo una alta clase de finura de las superficies. La carbonita es también perspectiva para su empleo en las coronas, instrumentos de afilado, hileras de estirar y las boquillas de hilado.
En ningún material policristalino artificial, claro está, se logra una estructura tan regular como en el monocristal de diamante. Los límites de los granos de polvo inicial de diamante poseen unas propiedades absolutamente distintas de las de las propias partículas. Durante el afilado de los conjuntos compactos de diamante, en la arista cortante, con un gran aumento, se ve la “sierra” -los dientes de los granos iniciales. El monocristal de diamante afilado no tiene esta “sierra”.
§. Nitruro de boro
El relato sobre los materiales policristalinos superduros sería incompleto si no nos familiarizamos con el nitruro de boro. Este compuesto químico no se encuentra en la naturaleza, pero ha sido sintetizado análogamente a las formas de carbono: al grafito le corresponde el nitruro de boro semejante al grafito, al diamante con red cúbica, el nitruro de boro cúbico, a la lonsdeilita, su modificación de nitruro de boro. La diferencia en las densidades y las distancias mínimas entre los átomos en el diamante y en el nitruro de boro cúbico constituye menos de 1,5%. El nitruro de boro cúbico, así como el diamante, es un material extraduro. Este se obtiene del nitruro de boro semejante al grafito mediante su síntesis a altas presiones en presencia de catalizadores.
Las modificaciones superduras del nitruro de boro se utilizan como material abrasivo, pero con mayor frecuencia en los conjuntos compactos policristalinos.
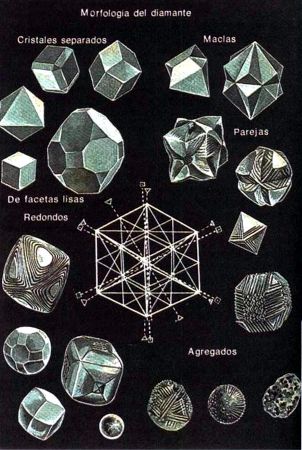
Las cuchillas de nitruro de boro poseen una serie de ventajas en comparación con el diamante. El nitruro de boro no interacciona químicamente con el hierro- y con su ayuda se pueden elaborar los aceros y los metales ferrosos, con la particularidad de que se pueden trabajar incluso los aceros templados más duros, cosa que tiene gran importancia para la técnica.
Efectivamente, en muchos procesos tecnológicos al principio se fabrica el artículo y luego se somete a temple para atribuirle a la superficie gran dureza. Por ejemplo, en los tubos para la perforación a considerables profundidades primero se ejecuta el roscado, y luego los tubos se templan. Como resultado del temple, a causa de la irregularidad inevitable de las temperaturas, algunas dimensiones se distorsionan. Parte de los tubos se desechan. Aquí precisamente ayudan las cuchillas de nitruro de boro: con ellas se puede efectuar el roscado después del temple.
Las cuchillas a base de nitruro de boro tienen una ventaja más de gran importancia: su resistencia a los golpes. Por esta razón ellas se utilizan durante el corte con golpes, por ejemplo, por una superficie con orificios. Esta propiedad del nitruro de boro abre amplias posibilidades en el terreno de elaboración de metales. Así, se han sintetizado nuevos materiales extraduros. Al servicio del hombre han llegado el diamante artificial y el nitruro de boro. ¿Qué lugar importante ellos ocupan en la ciencia y técnica modernas?
Capítulo 11
Ciencia, técnica y diamante artificial
§. Diamante sintético para la ciencia y la técnica
Cada año se enredan más estrechamente esas nociones, aumenta la aportación de la ciencia y la técnica en la historia del diamante y se abren nuevas perspectivas de la utilización de este cristal maravilloso en sus distintas ramas. Ustedes ya leyeron sobre las profesiones obreras e investigadoras del “rey de los minerales”, se conocieron con la continuación de su historia, que fue creada por los hombres al sintetizar este cristal; ahora resta conocer lo nuevo que proporciona a la ciencia y la técnica el diamante artificial.
Con la invención y la introducción en la práctica de los métodos de producción del diamante ha aumentado considerablemente el volumen de su aplicación en la técnica. Además, los diamantes sintéticos desplazan cada vez con mayor perseverancia los diamantes industriales naturales... Así, si en el año 1962 en la Unión Soviética la cantidad en peso de los diamantes industriales naturales utilizados era igual a la de los sintéticos, en 1971 la parte de diamantes artificiales constituyó ya un 85%. Y esta parte aumenta continuamente, pues las grandes fábricas modernas de construcción de maquinaria consumen anualmente centenas de miles de quilates de diamantes en artículos de centenas de denominaciones. Al aumento de la parte de los diamantes artificiales contribuye en un grado considerable su menor precio. Por ejemplo, en el mundo (sin contar la Unión Soviética) los diamantes sintéticos forman en peso cerca del 80% de todos los diamantes, mientras que su precio se expresa en el 25-30% del precio total de todos los diamantes.
Últimamente se elevaron considerablemente las exigencias planteadas a los distintos procesos y operaciones tecnológicos, en particular, a la calidad de elaboración de las superficies de uno u otro material. Como se sabe, cuanto más bajos son los salientes en la superficie elaborada, tanto más elevada es la clase de su finura. Convencionalmente se distinguen 14 clases de finura, con la particularidad de que la más alta de ellas se caracteriza por la magnitud de los salientes no mayor de 0,1 μ. Los métodos de elaboración, que se utilizan en la actualidad, digamos, por ejemplo, del metal prevén el alcance de la más alta finura de la superficie ya después de las primeras operaciones. Así, inmediatamente después del corte es deseable obtener una superficie que no requiere el ulterior rectificado y pulido. Esto se puede lograr con una herramienta a base de diamante artificial.
No obstante, antes de preparar la herramienta de diamante, se debe conocer exactamente el tipo de diamante que se necesita. Los diamantes sintéticos, así como los naturales, se emplean en la mayoría de los casos en forma de polvos. Cada polvo tiene su característica, elaborada para éste por la Norma Estatal de la URSS. Conforme a la Norma Estatal de la URSS vigente los polvos de diamante se dividen en dos grupos: los polvos para rectificar y los micropolvos. Se puede considerar (aproximadamente) que al primer grupo pertenecen los polvos de diamante con un tamaño de las partículas mayor que 60 μ, y al segundo, con un tamaño de las partículas menor que 60 μ.
La grosura del polvo de diamante desempeña un papel importante en su aplicación práctica. Si el polvo de diamante se emplea para obtener superficies lisas, entonces él debe ser muy fino. Para la elaboración por abrasión en basto son útiles unos polvos de diamante de granos gruesos.
En la actualidad, de los diamantes sintéticos se preparan unos cuantos tipos de polvos de diamante para rectificar.
Los diamantes de la marca ACO (ASO) se sintetizan en un régimen que garantiza de antemano la fragilidad, resistencia y superficie desarrollada requeridas. Estos están destinados para la fabricación de herramientas a base de aglutinante orgánico, que se utilizan para las operaciones en fino y de acabado. La elevada fragilidad de los polvos ACO (ASO) ya al embotarse insignificantemente el grano, conduce a la formación de nuevas aristas cortantes, a sea, al autoafilado. La herramienta de “autoafilado” garantiza un bajo esfuerzo de corte y baja temperatura de ractificado.
Los diamantes ACP (ASR) son aproximadamente 2 veces más resistentes que los ASO y menos frágiles. A base de estos diamantes se fabrican herramientas con aglutinante cerámico y metálico.
Los diamantes ACB (ASV) poseen una resistencia aún mayor y se utilizan en las herramientas que trabajan con cargas elevadas.
Los diamantes ACK (ASK), por su fragilidad y resistencia, son idénticos a los diamantes naturales, tienen un buen facetado. Estos se producen de un tamaño de hasta 500 μ. Las herramientas con estos diamantes se utilizan en condiciones particularmente pesadas, por ejemplo, al cortar y elaborar la piedra natural y el hormigón armado.
Los diamantes de la marca ACC (ASS) son característicos por ,su mínima fragilidad y máxima resistencia, que supera incluso la resistencia de los diamantes naturales. Éstos se producen de un tamaño de hasta 630 μ. A la par con los diamantes naturales ellos sirven en la herramienta de perforación, para la rectificación de muelas, al cortar corundio y el propio diamante. Corrientemente los diamantes ASS son monocristales transparentes y bien facetados.
De los polvos de diamante de las marcas ACM (ASM) y ACH (ASN) se preparan suspensiones y pastas. Pueden ser empleados en las herramientas. A base de los micropolvos, por vía galvánica, se preparan unos discos de cortar muy finos para la microrradioelectrónica. Los micropolvos de diamante durante el tratamiento dan la clase más alta de finura, lo que tiene gran importancia para la microrradioelectrónica, la óptica, en la preparación de espejos de los generadores ópticos cuánticos, láseres.
Los polvos de diamante se clasifican en fracciones estrechas conforme al tamaño de los granos. Los polvos para rectificar se separan con ayuda de tamices, y los micropolvos, con auxilio de centrifugadoras. Por ejemplo, la denotación ASS 630/500 significa que éstos son diamantes del tipo ASS. en los cuales el tamaño predominante constituye de 500 a 630 g; ASM 2/1, que éste es un micropolvo de diamante con el tamaño predominante de los granos de 1 a 2 μ, etc. En relación con los problemas de la nueva técnica, actualmente se dominan nuevas granulaciones de polvos finos de diamante, los llamados submicropolvos. ¡Se obtienen polvos con un tamaño de las partículas de hasta 0,7; 0,5; 0,3 e incluso hasta 0,1 g!
Esto significa que el tamaño principal de las partículas en este submicropolvo no debe sobrepasar de 1.000 Angstroms.
Las exigencias planteadas a los micropolvos, y particularmente a los submicropolvos, son incomparablemente más altas que a los gruesos polvos de diamante para rectificar. Efectivamente, sólo un grano grueso de diamante que caiga en el submicropolvo, puede reducir a cero todas sus excelentes cualidades. Pues los polvos finos están destinados para la elaboración de terminado, de acabado superfino de las piezas de cargas, en este caso la rugosidad de la superficie se mide en fracciones de micrón. Y de repente en esta superficie el controlador observa unos trazos brillantes y profundos, dejados por el único grano que no se sabe cómo cayó en el polvo. Se echa a perder el trabajo de una gran cantidad de personas en el transcurso de muchos días.
No hay que pensar que cuanto más grueso sea el polvo de diamante, tanto más caro será el mismo. Esto no es del todo así, mejor dicho, es así únicamente hasta una granulación determinada. Sin embargo, los micropolvos más finos son más caros que los gruesos, y los submicropolvos tienen el mismo precio que los más grandes diamantes sintéticos (naturalmente que con el recálculo no por un grano, sino por un quilate).
Esto se debe a las dificultades de eliminar, por ejemplo, con ayuda de centrifugadoras, las partículas que superan un tamaño determinado.
Los consumidores principales de diamantes son no sólo la construcción de maquinaria (construcción de tornos, de aviones y de buques), sino también la geología, donde la eficacia de un quilate de diamante empleado durante la perforación es particularmente alta. En la geología y otras ramas han sido reconocidos los materiales de diamante policristalinos. Además, los conjuntos compactos de diamante (en las coronas, en los lápices para la rectificación de las muelas, etc.) es deseable fabricarlos mediante la sinterización de los polvos gruesos -desde 10 μ y más. En este caso es mejor utilizar una mezcla minuciosamente agitada de fracciones de polvo, fina y gruesa, con el fin de que las partículas menudas llenen los espacios entre las gruesas. Para la elaboración de las cuchillas por abrasión, las cuales experimentan principalmente compresión, es más racional tomar las fracciones menudas de los polvos de diamante -con un tamaño de las partículas incluso de hasta 0,1 μ. Con esto se logran las clases más altas de finura de las superficies elaboradas.
Los polvos de diamante han recibido su mayor aplicación en las muelas para la elaboración de metales. Aquí dio un gran efecto la introducción de metales tensoactivos en los polvos, propuesta por E, D. Schukin y V. N. Pertsov. En este caso el proceso de rectificación se acelera, y el plazo de capacidad de trabajo de las muelas se alarga. Aquí se manifiesta el efecto de facilitación de la destrucción de los cuerpos sólidos (en el caso dado de la superficie que se rectifica) bajo la influencia de la adsorción de las moléculas tensoactivas, descubierto por el académico P. A. Rebinder.
Naturalmente que el empleo de la herramienta de diamante requiere disponer de los correspondientes mecanismos modernos. Es inútil colocar la cuchilla de diamante en un torno deteriorado, desvencijado. La aplicación de los diamantes requiere un alto nivel total de la producción. Por otra parte, los tornos de alta precisión y alto rendimiento exigen una herramienta de materiales extraduros precisamente para asegurar una alta precisión y un gran rendimiento. No se puede parar el torno o una línea automática de producción cada cinco minutos para sustituir la herramienta desgastada.
No se puede no mencionar una aplicación importante más de los diamantes. Al comienzo del libro ya hablamos sobre los yunques de P. Bridgman, el pionero en las investigaciones de las altas presiones. Precisamente el dispositivo elaborado por él ha permitido alcanzar por primera vez altas presiones. El propio diamante sintético es en muchos aspectos la creación de la técnica de altas presiones. Resulta que también el diamante puede proporcionar mucho para el desarrollo de esta técnica. Esta relación mutua, reacción, es generalmente característica para la ciencia moderna, que se desarrolla impetuosamente, para la época de la revolución científico-técnica.
En el año 1959 se propuso sustituir los yunques fabricados de aleación dura por yunques de diamante. El primer instrumento semejante constaba prácticamente de dos cuerpos de brillantes, los vértices de los cuales estaban cortados. Por estos planos, por intermedio de un sistema de palancas y resortes, los diamantes se apretaban uno contra otro. Los cálculos han demostrado que en la plataforma de contacto entre los diamantes comprimidos se pueden alcanzar unas presiones que sobrepasan de un millón de atmósferas.
Las instalaciones con yunques de diamante eran lo suficiente simples y hasta hoy día se perfeccionan. No obstante, desde el principio surgió el problema sobre la determinación de las presiones verdaderas, obtenidas en este caso, es decir, sobre la graduación. Esta parte del problema se resolvió en el año 1,972, cuando para la medición de las presiones se utilizaba la variación del espectro de absorción del rubí. Al aumentar la presión una de las líneas del espectro del rubí se desplaza regularmente. Este desplazamiento se puede medir fácilmente con ayuda de los aparatos modernos, los espectrógrafos, y de este modo determinar la presión. Por esta razón, junto con los materiales que se investigan, entre los yunques de diamante se coloca un pequeño pedazo de rubí. Verdad que es una combinación interesante, el diamante y el rubí, sobre todo si se tiene en cuenta que para los contactos eléctricos, al pasar al estado metálico frecuentemente se utiliza el oro y el platino.
Es natural, que la obtención de presiones extraaltas no es un objetivo propio. Ante todo aparece la posibilidad de investigar el estado de distintas sustancias a altas presiones. Este problema desde hace mucho tiempo les provoca un interés extraordinario a los científicos que se ocupan de nuestra Tierra. Pues no en vano a veces se lamenta de que conocemos mucho más sobre las estrellas, que acerca de la estructura del planeta en el que vivimos. De acuerdo con las representaciones modernas la Tierra está compuesta por la corteza, el manto y el núcleo. La presión en el límite corteza-manto (en término medio la profundidad es de 100 km) constituye 10 mil atm, en la frontera manto-núcleo (a la profundidad de 3.000 km), cerca de 1,5 millones de at., y en el centro de la Tierra ella alcanza 35 millones de at. El empleo de los yunques de diamante les proporciona a los científicos un potente medio para el estudio, en primer lugar, de las propiedades de las sustancias que se encuentran en el manto.
Los métodos de presiones extraaltas pueden ser aplicados también para la resolución de problemas más comunes, por ejemplo, para investigar la variación de la velocidad de desintegración radiactiva al aumentar la presión, para estudiar las propiedades del líquido y los lubricantes. En las máquinas modernas el lubricante se encuentra bajo la acción de grandes presiones y puede surgir el fenómeno de endurecimiento, cuando el lubricante ya no cumple su función, es decir, no facilita el deslizamiento de las piezas en rozamiento. Antes se consideraba que el fenómeno de endurecimiento está relacionado con la formación de partículas vítreas grandes en el líquido. Las investigaciones con ayuda de los yunques de diamante permitieron sacar la conclusión sobre el hecho de que en las capas finas de los líquidos es posible la formación de una película muy viscosa cerca de la superficie, cosa que dificulta el movimiento de las piezas en rozamiento de las máquinas unas respecto a otras.
No obstante, el problema fundamental de utilización de las presiones extraaltas, que se alcanzan con ayuda del diamante, consiste en la superconductibilidad. A una temperatura determinada para cada conductor, la resistencia de este último a la corriente eléctrica disminuye hasta cero. Este fenómeno fue descubierto en el año 1911 por Kamerlingh-Onnes. En un anillo de superconductor la corriente eléctrica continua no se amortigua durante largo tiempo, por cuanto la resistencia eléctrica del superconductor es, por lo menos, 1017 veces menor que la del mismo conductor a temperatura ambiente. Para imaginarse esta parte hay que dividir la unidad entre otra unidad con diecisiete ceros, es decir, prácticamente es igual a cero.
Cabe señalar que la superconductibilidad, desgraciadamente, se alcanza a temperaturas demasiado bajas, que no superan en dos decenas de grados el cero absoluto, lo que requiere el empleo de helio liquido para la refrigeración de los conductores. La creación de superconductores capaces de trabajar a altas temperaturas es el sueño de los científicos. Es difícil hacerse una idea de la gran importancia que tendría la creación de un superconductor capaz de trabajar en condiciones de altas temperaturas. Pues esto significa el transporte de energía a enormes distancias sin pérdidas (actualmente una parte considerable de energía en las líneas de transporte de energía se pierde en vencer las resistencias), imanes superpotentes, etc. Por eso las investigaciones en el terreno de la superconductibilidad se llevan ampliamente a cabo en todo el mundo.
Las sustancias, al aplicarles altas presiones, pasan al estado metálico. En el año 1968 se indicó la posibilidad de que el hidrógeno metálico puede ser un superconductor casi a temperatura ambiente. Esta comunicación provocó una avalancha de trabajos para obtener hidrógeno metálico. En la Unión Soviética estos trabajos se desarrollan en el Instituto de Física de Altas Presiones de la Academia de Ciencias de la URSS. En el año 1972 los científicos de este instituto comunicaron acerca de la transición del hidrógeno al estado metálico a la presión de 1 millón de at con el uso de los yunques de diamante sintético. Ahora el problema inmediato en este dominio se reduce a aclarar la posibilidad de conservar el hidrógeno en estado metálico después de eliminar la presión, es decir, en las condiciones habituales.
Es necesario relatar sobre la transición al estado metálico del xenón, un gas inerte Solamente en el año 1961 se logró obtener el primer compuesto de xenón con el flúor. Hace poco los científicos del Instituto de Física de Altas Presiones, bajo la dirección de E. N. Yákovlev no sólo lograron convertir el xenón al estado metálico, sino que también a la temperatura de únicamente 7 o más alta del cero absoluto obtuvieron este elemento en estado de superconductor. Para ello se necesitó una presión de 500 mil at, la cual fue obtenida en una cámara especial de diamante policristalino.
La ciencia y la técnica modernas hacen mucho para que el diamante pueda manifestar más convincentemente sus propiedades únicas. Observen cómo en todo el camino del diamante, desde su formación hasta su aparición en el puesto de trabajo, le ayudan, le conforman y lo “visten” las todopoderosas ciencia y técnica.
El diamante está predestinado, en mucho, -a reemplazar las aleaciones duras, ampliamente empleadas, a base de carburo de tungsteno, incluyendo al famoso pobedit. Pero durante la aparición del diamante a éste le sirven las matrices de aleaciones duras, entre las cuales sucede la síntesis.
Para crear la presión necesaria para la síntesis se requieren prensas de una potencia enorme, que son la encarnación de las ideas más avanzadas de la ciencia y la técnica, la realización del alto nivel de maestría de los colaboradores de la industria. Precisamente así es la prensa que funciona en el Instituto de Física de Altas Presiones de la Academia de Ciencias de la URSS. Esta prensa es única por sus dimensiones y posibilidades. Ella desarrolla un esfuerzo de 50 mil t, “funciona” en un edificio aparte, y para su transporte se necesitó un tren especial.
Después de la síntesis el diamante se encuentra en forma de mezcla con el metal y el grafito que no ha reaccionado. Se purifica de ellos habitualmente con ayuda de distintas mezclas de ácidos, sometiendo el producto de la síntesis a su acción múltiple. El polvo de diamante, obtenido como resultado, se clasifica.
De los distintos tipos de diamantes se hacen herramientas muy diversas. Para fijar en ellas el diamante se emplean diferentes tipos de aglutinantes.
Es de gran importancia la sujeción de los diamantes en la herramienta de perforación, en la fabricación de las cuales se utilizan los cristales más grandes y caros. Pues, en la perforación es particularmente necesario que la herramienta trabaje el tiempo más largo posible. Para una mejor adherencia del diamante con el metal, las coronas o los trépanos se metalizan previamente -se cubren con una fina capa de metal. Antes de la metalización ellos se someten a la operación de ovalización: todas las facetas de los cristales se redondean, dándoles una forma ovalada. Claro que en este caso se pierde mucho diamante, se tritura, pero los diamantes ovalizados trabajan mejor que los iniciales; ellos no tienen salientes, debido a los cuales el diamante salta frecuentemente de su alojamiento en la herramienta.
Para la investigación de los diamantes se emplean los métodos modernos más potentes: de análisis de la estructura por rayos X, de resonancia paramagnética electrónica, de espectroscopia infrarroja, de microscopía electrónica de exploración y de radiografía y otros.
La historia de cómo primero se reveló la naturaleza química del diamante, después su estructura, luego se obtuvieron los diamantes sintéticos a altas presiones y a continuación se elaboró el método de acrecencia y formación de los diamantes del gas, es bastante sentenciosa. Ella muestra el poder de la ciencia (en particular de la química y la física), que permitió crear procesos y materiales, sobre los cuales en el siglo pasado no se podía ni soñar. Sin embargo, esto se ha hecho posible no de repente, ni mucho menos, sino sólo después de que se construyó un sólido cimiento científico.
El cimiento que permitió conocer la composición del diamante, se han hecho los fundamentos de la química. La estructura del diamante se ha aclarado después de elaborar los métodos de investigación que utilizan la difracción de los rayos X en los cristales. Los métodos de síntesis a altas presiones se basan en los logros de la teoría acerca de los equilibrios y las transformaciones de fase. Los métodos de síntesis en el dominio de la metaestabilidad del diamante se basan en la teoría sobre el mecanismo de formación de una nueva fase. Los métodos y aparatos para la valoración de la grosura de los granos de polvo se basan en la utilización de la teoría cinética de los gases y su filtración a través de cuerpos porosos.
Todas las elaboraciones científicas fundamentales enumeradas han obtenido aplicación práctica en la resolución de una multitud de problemas no relacionados con el diamante, pero que indudablemente serán utilizadas en lo sucesivo para perfeccionar los métodos de su síntesis y su estudio. Es indudable también que para la formación ulterior de nuestros conocimientos sobre el diamante serán precisas otras ramas de la ciencia, tanto las ya elaboradas, como también nuevas, que serán desarrolladas en lo sucesivo.
Todo esto muestra evidente y convincentemente el extraordinario valor de las llamadas investigaciones científicas fundamentales, que permiten abarcar y poner al servicio del hombre amplios campos de los fenómenos de la naturaleza. A su vez, los resultados obtenidos, en este caso, frecuentemente son útiles para el desarrollo de la propia ciencia.
La historia del diamante atestigua una vez más sobre la inagotabilidad de la naturaleza y la infinidad del proceso de conocimiento. Hemos conocido sobre el diamante mucho e incluso lo hemos preparado, pero al mismo tiempo hemos estudiado muy insuficientemente este mineral. Por ejemplo, siguen llenas de enigmas las propiedades de los materiales policristalinos extraduros a base del mismo, no están claras las particularidades de su estructura y el mecanismo de su sinterización. Es muy probable que en los límites de los granos, al aplicar altas presiones, se formen estructuras diferentes de las ya conocidas. Por eso, los científicos aplican muchas fuerzas y prestan gran atención a la relación de los fenómenos que trascurren durante la sinterización del diamante.
En el ejemplo de las investigaciones acerca de la síntesis del diamante sea a altas presiones, o durante la cristalización en la fase gaseosa, se sigue sobre todo convincentemente la ligazón de las distintas escuelas y direcciones científicas. El estudio del mecanismo de formación de los diamantes en la naturaleza estimula el planteamiento de nuevos experimentos en los laboratorios. Y al contrario, los resultados obtenidos en los laboratorios contribuyen a la presentación de nuevas ideas acerca del origen de los diamantes naturales. Al concluir su libro “Origen de los diamantes” los científicos soviéticos V. G. Vasílev, V. V. Kovalski y N. V. Cherski escriben:
“La revelación del mecanismo de formación de los diamantes en la naturaleza representa no sólo interés teórico, sino también tiene una gran importancia práctica. La resolución de este problema secular permitirá determinar el mejor material inicial y las condiciones para la producción de diamantes artificiales con parámetros fijados de antemano, así como precisar los criterios para las búsquedas de chimeneas de kimberlita diamantíferas y placeres”.
Como es conocido, las nuevas ideas surgen con mayor frecuencia en el empalme de distintas disciplinas científicas. Combinando las investigaciones en el dominio de la física, geología y química, el geoquímico E. M. Galímov presentó una nueva teoría sobre la formación de los diamantes, confirmándola con cálculos de las reacciones químicas, la fluencia del magma fundido, con cálculos termofisicos.
Si conforme a la teoría de V. G. Vasílev, V. V. Kovalski y N. V. Cherski las presiones necesarias en el magma surgen como resultado de la explosión de la mezcla de gas, o sea, debido a la marcha de una reacción química rápida, según la teoría de Galímov la presión es provocada por una causa puramente física -por la formación de burbujas de gas carbonoideo, o sea, por la cavitación.En este caso se crean presiones de impulso muy altas, una forma de microexplosiones. La cavitación es bien conocida por los científicos: precisamente ella destruye las palas, que giran rápidamente, de las hélices de los buques, la superficie de las cuales resulta toda “roída” en forma de diminutos embudos. Este fenómeno puede surgir al ensancharse espontáneamente el canal, por el cual fluye a gran velocidad el líquido, si en este líquido se encuentra disuelto gas. Galímov confirmó con ayuda de sus cálculos, que en el magma fundido se forman burbujas de gas, la cavitación de las cuales conduce luego a un aumento local de la presión hasta millones de atmósferas, y de la temperatura, hasta 10 mil grados. En este caso el gas carbonoideo se descompone y forma diamante. Semejantes procesos transcurren más de una vez. Efectivamente, en los diamantes naturales se distingue una estructura complicada, como si una capa se acrecentara sobre otra con ciertas paradas.
Ambas teorías de explosión permiten aclarar algunos de los fenómenos que se observan en la naturaleza: el contenido de diamantes en unas chimeneas de kimberlita y la ausencia de éstos en otras, situadas al lado; la obtención de cristales perfectos; la distribución de los diamantes en la roca y otros. Los mecanismos propuestos encuentran su confirmación también en el experimento realizado en el Instituto de Química Física.
Los autores de este libro razonaban de la siguiente manera: al descomponerse los hidrocarburos se forma negro de carbón, y no grafito, pese a que el negro de carbón es metaeslable con respecto al grafito. Por lo tanto, de por sí la metaestabilidad no es una interdicción para ¡a formación de partículas de carbono de distintas modificaciones estructurales. Los cálculos han confirmado esta suposición y, aun más, han demostrado que a cada forma estructural del carbono: negro de carbón, grafito y diamante, le corresponde una zona de condiciones, cuando su formación se hace preponderante. Se planteó el experimento de la cristalización del carbono en una burbuja de vapores de líquido, calentados hasta altas temperaturas. En los productos de la descomposición se obtuvieron cristales menudos de diamante junto con partículas de grafito, de negro de carbón y carbinos.
Nuestro libro ha sido dedicado principalmente al diamante, parcialmente a otras formas de carbono. Éstos son unos objetivos muy importantes de investigación. Pero los autores desearían concluir el libro con la afirmación de que los químicos pueden preparar no sólo diamantes. Hay ejemplos de la obtención de otras sustancias importantes por el método de cristalización química de la fase gaseosa durante las reacciones químicas. Que el lector acoja el último capítulo como prólogo de un libro nuevo, todavía no escrito.
Capítulo 12
Los químicos preparan no sólo diamantes
El diamante, por ser una piedra preciosa, es en cierto sentido un material especial. Pero el poder de la química se manifiesta no menos convincentemente también en la creación de otros materiales extraduros. Un ejemplo es la creación del nitruro de boro, que no se encuentra en la naturaleza, que últimamente ha adquirido amplia aplicación. En la industria moderna desempeñan un gran papel los piromateriales, que se obtienen como resultado de la cristalización química de la fase gaseosa a temperaturas elevadas (su denominación se ha formado de la palabra griega “fuego”). En la actualidad la cantidad de piromateriales obtenidos en los laboratorios y fábricas es enorme.
Precisamente, el primer piromalerial conocido por el hombre es el negro de carbón. El electrotécnico ruso, el inventor de la lámpara de incandescencia A. N. Lodíguin obtuvo tungsteno para el filamento incandescente mediante la descomposición del cloruro de tungsteno volátil. En los años 20 de nuestro siglo se elaboró el método de yoduro de obtención de metales puros, el cual se hizo la base de la producción industrial del circonio, titanio y hafnio plásticos y otros metales más.
En el Instituto de Química Física de la Academia de Ciencias de la URSS, A. I. Krasovski y R. K. Chuzhkó investigaron detalladamente e introdujeron en la industria el método de fluoruro de obtención del tungsteno.
Este método se basa en la reacción:
WF2 + 3H0 = W + 6HF
la cual, claro está, no refleja todo el cuadro del proceso. De las investigaciones de los autores indicados se desprende que la precipitación del tungsteno sobre la superficie pasa por la etapa de adsorción activada de hidrógeno. Precisamente esta circunstancia hace posible llevar a cabo el proceso a una temperatura de 500 a 600 ºC. Señalemos que la temperatura de fusión del tungsteno supera los 3.000 ºC, y la temperatura de ebullición es cerca de 6.000 ºC. No obstante, el llamado fluoruro de tungsteno supera por sus propiedades al tungsteno obtenido por los métodos de la metalurgia de polvos (mediante la sinterización del polvo de tungsteno bajo carga a alta temperatura en el transcurso de largo tiempo).
Valiéndose de los métodos de cristalización química de la fase gaseosa se obtienen tales metales duros como el carburo de titanio, al descomponer una mezcla de cloruro de titanio, metano e hidrógeno a 1.200 ºC, nitruro de aluminio bajo el efecto de una temperatura de 1.100 ºC sobre una mezcla de cloruro de aluminio y amoníaco en un flujo de argón. En general, la particularidad característica de la obtención de materiales de alta temperatura de fusión por vía química consiste en que la temperatura del proceso no sobrepasa de la mitad de la temperatura de fusión. Por ejemplo, el cromo, que tiene una temperatura de fusión igual a 1.800 ºC, puede ser obtenido descomponiendo los compuestos orgánicos de cromo a temperatura de 300 ºC.
Han obtenido un desarrollo considerable los métodos de precipitación de la fase gaseosa de tales semiconductores, de gran importancia industrial, como el silicio. A la temperatura de 1.150 ºC el silicio se obtiene conforme a la reacción:
SiCl4 + 2H2 = Si + 4HCl
Si a la mezcla inicial se le añade metano, entonces ya a 1000 ºC se puede obtener carburo de silicio.
El empleo de los piromateriales ha dado mucho para el desarrollo de la nueva técnica y el perfeccionamiento de los métodos tradicionales, de los aparatos y las herramientas. Así, la aplicación de finas capas (de hasta 10 micrones) de carburo de titanio sobre las cuchillas de pobedít aumentó varias veces el plazo de su servicio.
El breve resumen expuesto sobre los métodos químicos de cristalización de la fase gaseosa de distintas sustancias, demuestra su poder. Se puede decir que nos hacemos los testigos del nacimiento de una nueva rama de la industria. Y por cuanto la técnica presenta cada vez más exigencias a la calidad de los materiales y a los métodos, económicamente ventajosos, de su obtención, todavía queda mucho trabajo por hacer en este terreno.
F I N